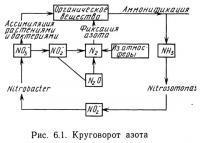
Круговорот азота
Азот относится к исключительно важным биогенным веществам, поскольку он является необходимым элементом в структуре белков. Азот содержится также в хлорофилле, РНК, ДНК, некоторых коферментах и витаминах. Таким образом, азот необходим для осуществления таких важных процессов, как фотосинтез, дыхание, синтез белка, образование генов и рост.
В водной среде азот встречается в различных формах, чаще всего в виде нитратов NO-3, нитритов NO-2, аммиака NH3, аммония NH+4, свободного газообразного азота N2 и в виде органических форм, таких, как аминокислоты и белки. Переход из одной формы в другую может происходить в результате простых химических реакций, однако чаще всего он является результатом биологических процессов. На рис. 6.1 схематически представлен круговорот азота в водной среде.
Целью круговорота азота является его многократное использование. На стадии органического вещества азот находится в связанном состоянии в виде белков и других веществ в тканях растений и животных. После гибели организма бактериальное и химическое окислительное разложение приводит к образованию аммиак NH3 и небольших количеств таких его соединений, как гидроокись аммония и углекислый аммоний. Бактериальное дезаминирование (удаление аминогруппы NH2 из аминокислоты) — еще один источник аммиака, присутствующего в водных системах.
Аммиак NH3 и ион аммония NH+4 могут существовать в вод-ной среде одновременно в результате протекания обратимой реакции. Константа равновесия этой реакции в значительной степени зависит от pH среды. В табл. 6.3 приведены значения концентраций неионизированного аммиака NH3 в растворе гидроокиси аммония при различных pH. Данные, полученные различными исследователями (Burrows, 1964; Liao and Mayo, 1972; Brockway, 1950), подтверждают высокую токсичность NH3 для водных организмов, в то время как NH+4 переносится ими в значительно более высоких концентрациях. Из табл. 6.3 видно, что при значениях pH выше 7 аммиак присутствует в растворе в значительных концентрациях, что может оказать летальное или сублетальное токсическое действие. Пресноводные искусственные системы с высокой плотностью посадки обычно функционируют при pH от 6,5 до 7,5. В системах с соленой водой pH обычно поддерживается в диапазоне 7—8,5. Таким образом, риск аммиачного отравления в соленой воде выше, чем в пресной.

Образование нитритов NO-2 в азотном цикле происходит в результате протекания двух процессов. При разрушении аммиака нитрифицирующими бактериями типа Nitrosomonas высвобождаются нитриты. Выделяющаяся при этом энергия используется в биологических процессах. Некоторые диатомеи и водоросли, например Chlorella, обладают способностью превращать нитраты NO-3 в нитриты NO-2. Такое восстановление — второй источник нитритов в водных системах.
На заключительном этапе круговорота азота происходит окисление нитритов до нитратов бактериями Nitrobacter sp. Выделяющуюся энергию бактерии используют в процессе своей жизнедеятельности. Нитраты — это та форма неорганического азота, которая легче всего усваивается большинством растений.1 Круговорот завершается поглощением азота растениями, поскольку в растениях азот включается в состав органических соединений.
В процессе денитрификации нитрата получается сначала нитрит, а затем газообразный азот N2 или сначала газообразная закись азота, а затем газообразный азот N2. Этот процесс требует дополнительной затраты энергии при использовании неорганического источника водорода и протекает в анаэробных условиях.
В круговороте азота может также происходить и фиксация азота. При этом газообразный азот поглощается и включается непосредственно в состав органических соединений. Этот процесс также требует затрат энергии.
Ниже приводятся химические реакции, характеризующие различные этапы круговорота азота:
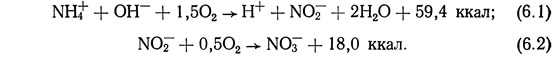
Как уже отмечалось, в ходе реакций, описанных уравнениями (6.1) и (6.2), происходит выделение энергии. Превращение неорганического азота в органический осуществляется при поглощении солнечной энергии. Полное уравнение процесса фотосинтеза имеет вид
Энергетические соотношения при нитрификации зависят от характера источника водорода. Если источник водорода органический, в результате реакции, описанной уравнением (6.4), происходит выделение энергии (Spotte, 1970):
Если водород получается из неорганического источника, для осуществления реакции требуется дополнительная энергия:
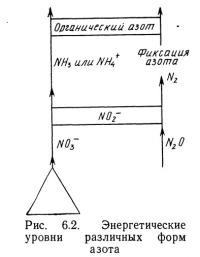
Следует отметить, что реакция с использованием органического источника водорода может протекать в отсутствие кислорода. В результате реакции образуются газообразный азот, вода и двуокись углерода. При использовании неорганического источника водорода [уравнение (6.5)] в результате реакции образуется кислород. Энергетические аспекты представлены в виде диаграммы на рис. 6.2. На этой диаграмме вертикальное движение вверх требует затрат энергии. Вертикальное перемещение вниз приводит к выделению энергии, необходимой организмам, участвующим в процессе разложения.
Для стабильных водных систем обычно характерны низкие концентрации аммиака (менее 1 мг/л) и нитритов, а концентрации нитратов пропорциональны количеству поступающего в систему азота. На начальном этапе создания искусственной системы или при значительном загрязнении (особенно органическими веществами) естественных водоемов равновесие между различными формами азота нарушается. Обычно в этих случаях происходит увеличение содержания аммиака и нитритов.- Аммиак даже в довольно низких концентрациях приводит к гибели рыб и других живых организмов. Например, сеголетки лосося могут испытать стресс, если их выдерживать в течение 12 ч в день в воде, содержащей 0,1 мг/л NH3 (Burrows, 1964). Нитриты также токсичны, однако их токсичная концентрация значительно выше, чем неионизированного аммиака. Если нитраты — конечный продукт разложения в аэробных системах — не будут поглощаться растениями или выводиться из системы другими способами, содержание их будет увеличиваться, но, поскольку нитраты токсичны только при очень высоких концентрациях, это не опасно.
Круговорот фосфора
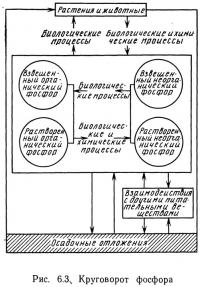
Фосфор является лимитирующим биогенным элементом для некоторых водных систем. Подобно азоту, фосфор участвует в сложном круговороте, который упрощенно показан на рис. 6.3. Химические формы фосфора в водных системах исключительно разнообразны — от неорганических ионов фосфатов до таких органических молекул, как сахара и ДНК. Химическое равновесие между различными формами зависит от многих параметров, включая pH среды, концентрацию ионов таких металлов, как кальций и алюминий, окислительно-восстановительный потенциал, степень взмучивания донных осадочных отложений и наличие загрязнений.
Поскольку химические реакции, в которые вступает фосфор в водной среде, а также кинетика реакций четко не определены, принято различать следующие формы фосфора: взвешенный органический фосфор, растворенный органический фосфор, взвешенный неорганический и растворенный неорганический фосфор.
На рис. 6.3 представлена схема круговорота фосфора с учетом этой классификации.
Фосфор содержится в различных тканях живых растений и животных. После гибели организмов их ткани разрушаются под действием химических или биологических процессов. При этом образуются все формы фосфорсодержащих соединений: органические и неорганические взвешенные вещества, а также органические и неорганические растворенные вещества.
В любой водной системе эти формы взаимодействуют. Органические формы переходят в неорганические в результате химических или биологических процессов. Неорганические формы переходят в органические в основном под действием биологических процессов и требуют дополнительной энергии. Превращение взвешенных веществ в растворенные и наоборот может быть следствием как химических, так и биологических процессов. Все четыре формы фосфора могут использоваться непосредственно различными организмами и трансформироваться в тканях других живых организмов.
Взаимодействие между различными формами фосфора происходит как в водном столбе, так и в осадочных отложениях. Поступление фосфора из отложений зависит от химических свойств окружающей среды и характера взаимодействия других ионов с фосфором. Например, значительное количество фосфора поглощается гидроокисями и окисями железа. Уменьшение окислительного потенциала (например, при уменьшении содержания растворенного кислорода) приводит к растворению гидроокисей и окисей железа. При этом высвобождается фосфор и его концентрация в воде увеличивается (Kramer et al., 1972). Сходным образом фосфор вступает во взаимодействие и с другими ионами, что является одной из причин отсутствия полной ясности в вопросе о химических взаимодействиях фосфора.
Взаимодействие фосфора водного столба и осадочных отложений, по-видимому, способствует поддержанию довольно постоянного содержания фосфора в воде. Когда этот процесс будет изучен, появится возможность регулировать концентрацию фосфора в естественных озерах. В настоящее время более 75% фосфора, содержащегося в сточных водах, можно удалять -его осаждением соединениями алюминия и железа. Однако с экономической точки зрения контролировать содержание фосфора целесообразно только в очень небольших озерах и прудах.
Круговорот углерода
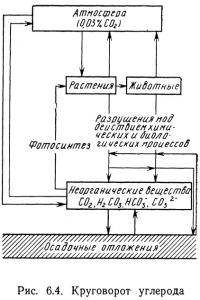
Углерод необходим для образования любого органического соединения. Чаще всего углерод встречается в составе двуокиси углерода СО2, бикарбоната НСО-3, карбоната СO2-3, угольной кислоты Н2СO3 и органических соединений. Круговорот углерода схематически представлен на рис. 6.4.
Основными источниками углерода являются атмосфера и осадочные породы. В атмосфере углерод существует в виде двуокиси углерода, а в осадочных породах в основном в виде карбонатов, чаще всего кальция СаСО3 и магния MgCО3. В водных системах-содержится также значительное количество органического и неорганического углерода. Органические формы образуются в результате биологического и химического разрушения мертвых растений и животных. К основным неорганическим соединениям относится углекислый газ, угольная кислота, бикарбонаты и карбонаты. В ходе химических и биологических процессов ткани мертвых растений и животных разрушаются с образованием неорганического углерода; возможно также их осаждение после частичного разложения. Обмен двуокисью углерода, происходящий между атмосферой и водой, поддерживает равновесную концентрацию углерода в воде. Растения, способные фотосинтезировать, поглощают неорганический углерод и на свету преобразуют его в органические соединения углерода. Необходимую для фотосинтеза двуокись углерода растения могут получать непосредственно из воздуха; не имеющие корней водные растения обычно извлекают двуокись углерода из воды. Двуокись углерода, выделяемая растениями и животными при дыхании, поглощается водой, однако, если ее концентрация становится слишком высокой, избыток двуокиси углерода поглощается атмосферой.
Между водой и осадочными отложениями происходит обмен органическим и неорганическим углеродом. Основной запас углерода содержится в карбонатных породах. Растворение карбонатов — один из факторов, обеспечивающий поддержание в течение длительных периодов постоянных значений pH морских и пресноводных систем. В донных отложениях озер и океанов присутствует также органический углерод. Его биологическое и химическое разрушение также приводит к увеличению содержания углерода в водном столбе. Вместе с тем увеличение содержания углерода в донных отложениях происходит при опускании мертвых биологических организмов на дно.
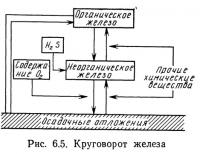
Круговорот железа
Круговорот железа схематически представлен на рис. 6.5. Железо входит в состав многих химических соединений, присутствующих в вод* ной среде. Самыми распространенными из них являются соединения с двухвалентными Ре2+ и трехвалентными Fe3+ ионами железа, гидроокись железа, сернистое железо и различные органические соединения. Фосфорнокислое железо — связующее звено в круговоротах железа и фосфора.
Валентность железа в образуемых им соединениях в значительной степени зависит от концентрации кислорода в воде и в осадочных отложениях. Аэробные условия благоприятствуют образованию соединений, содержащих трехвалентное железо. Поскольку трехвалентное железо практически нерастворимо при значениях температур и pH, характерных для природных систем, в аэробных условиях такие соединения выпадают в осадок. Одно из соединений трехвалентного железа — гидроокись железа — часто бывает связано с органическими веществами. При разрушении бактериями органического вещества происходит высвобождение и постепенное выпадение в осадок гидроокиси железа. В результате этого процесса часто образуется озерная охра, с которой связано происхождение железной руды.
Анаэробные условия способствуют образованию соединений, содержащих двухвалентное железо. Поскольку они имеют значительно большую растворимость, концентрация ионов железа значительно больше в анаэробных условиях, чем в аэробных. Однако если в анаэробных условиях выделяется сероводород, трехвалентный ион железа образует с сульфидом практически нерастворимое сернистое железо. Эта реакция ограничивает содержание ионов железа в воде даже в анаэробных условиях. Анаэробные условия способствуют также вымыванию железа из осадочных отложений в результате растворения соединений, содержащих ионы трехвалентного железа. На рис. 6.5 показано влияние на круговорот железа кислорода и сероводорода, а также других веществ, вступающих в реакции с железом, в первую очередь фосфора.
Органическое железо, содержащееся в тканях живых и останках погибших организмов, может в результате химического и биологического разложения переходить в неорганические формы. Часть органического железа непосредственно переходит в осадочные отложения. Существует также несколько видов железобактерий, которые утилизируют энергию, выделяющуюся при окислении различных солей двухвалентного железа, например карбоната или бикарбоната железа (Hatchinson, 1957). К таким железобактериям относятся Leptothrix ochracea и Spirophyllum ferrugineum.
Круговорот железа сложен и недостаточно изучен. Для уточнения схемы круговорота железа и определения количественных соотношении различных реакций требуется проведение дополнительных исследований.
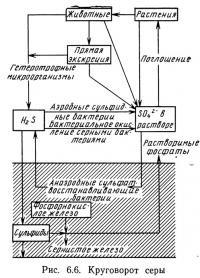
Круговорот серы
В природных системах осуществляется также круговорот серы. Чаще всего неорганическая сера встречается в водном столбе в виде сероводорода H2S и ионов сульфатов SO2-4. Сероводород обычно является продуктом анаэробного разложения. Ионы сульфатов представляют собой наиболее легко поглощаемую растениями форму серы. Таким образом, в круговороте серы, как и в круговоротах других питательных веществ (рис. 6.6) разложение органической серы происходит с образованием неорганических форм. Неорганические формы поглощаются растениями, которые затем поедаются животными. Важную роль в круговороте серы играют серные бактерии различных типов. Аэробные бактерии превращают сероводород сначала в серу, а затем в сульфаты:
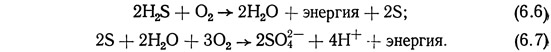
Эти бактерии используют энергию, выделившуюся при окислении сероводорода, для осуществления своих клеточных функций. При этом бактерии превращают сероводород — довольно токсичное соединение серы — в нетоксичные сульфаты. Некоторые серные бактерии, такие, как бесцветная, пурпурная и зеленая, а также некоторые аэробные сульфидные бактерии, например Thiobacilli, участвуют в одном или нескольких таких процессах.
Анаэробые бактерии типа Desulfovibrio преобразуют ионы сульфата осадочных отложений в сероводород в присутствии соединений углерода, обеспечивающих необходимую для этого энергию. Этот процесс описывается следующим уравнением:
Кроме того, круговорот серы связан с круговоротами фосфора и железа. В осадочных отложениях с недостаточным содержанием кислорода происходит осаждение сульфидов. Некоторые из них вступают в реакции с нерастворимыми соединениями фосфора, например с фосфорнокислым железом, и образуют нерастворимые сульфиды железа. Соединение железа и серы приводит к образованию такой растворимой формы фосфора, как HPO2-2 и PO2-4. Таким образом, в анаэробных условиях и при высоких концентрациях серы содержание сернистого железа увеличивается и соответственно должно увеличиваться содержание фосфора в водном столбе. Реакции, происходящие в круговороте серы, регулируют уровень содержания фосфора в воде. Зависимость между круговоротами различных биогенных элементов наблюдается довольно часто, хотя кинетика и характер этих взаимоотношений еще детально не изучены. Известно, например, что на них влияет pH воды, однако количественные соотношения, определяющие это влияние, пока не получены. Существующие зависимости крайне сложны и изменяются во времени и пространстве в зависимости от изменяющихся характеристик водных систем.
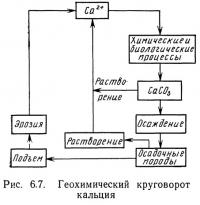
Круговорот кальция
Круговороты кальция и углерода связаны взаимодействием двуокиси углерода, карбонатов и карбоната кальция. Схема геохимического круговорота кальция представлена на рис. 6.7. Этот круговорот осуществляется в течение очень длительных периодов времени, поскольку подъем осадочных пород редко происходит менее чем за несколько тысяч лет. Постоянным источником кальция в водах естественных пресноводных и морских систем является растворение осадочных пород, а также раковин морских организмов типа устриц или двустворчатых моллюсков. Осаждение и образование карбоната кальция происходит в результате биологических и химических реакций. Круговорот кальция зависит также от pH водной среды, влияющего на буферную систему двуокиси углерода (в которой также участвует карбонат). Вместе с тем участие его в буферной системе позволяет поддерживать pH водных систем относительно постоянным.
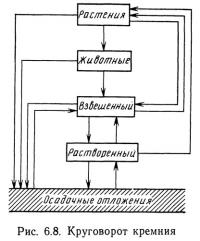
Круговорот кремния
Кремний утилизируется в первую очередь в оболочках диатомовых водорослей. Он также содержится в цистах некоторых видов желто-коричневых водорослей и в спикулах кремниевых губок.
Круговорот кремния представлен на рис. 6.8. Кремний присутствует в водной среде в растворенном и взвешенном виде, а также входит в состав наружного скелета диатомовых водорослей и других организмов. Растения поглощают растворенный кремний. Животные получают кремний, поедая растения. Проходя через пищеварительную систему животных, кремний, как правило, не поглощается, а выделяется с экскрементами. Однако прохождение через пищеварительную систему приводит к ускоренному разрушению оболочки диатомовых водорослей. Образующиеся при этом взвешенные частицы кремния могут непосредственно поглощаться растениями или растворяться.
Концентрация кремния в воде зависит от обмена с донными отложениями и от скорости разрушения кремнийсодержащих растений. Таким образом, время цикла кремния зависит от химических и биологических факторов. На круговорот кремния влияют концентрация кислорода, температура воды, концентрация других биогенных веществ. Алюминий, который может образовывать с кремнием комплексные соединения, а также вступает в реакции с фосфором, является связующим звеном между круговоротами фосфора и кремния. Фосфор может также вступать в реакции с серой и железом и связывает круговороты этих веществ с круговоротом кремния.
Примечания
1. Наиболее усвояемой формой азота является аммоний, а для того чтобы ассимилировать нитраты, растениям приходится их предварительно восстанавливать до аммония с помощью нитрат-редуктазы.