Химическая структура
Химически молекула воды состоит из одного атома кислорода и двух атомов водорода, связанных между собой таким образом, что каждый из атомов водорода делится своим единственным электроном с кислородным атомом. Такая связь называется ковалентной. Атомы водорода расположены под углом 104,5° по отношению к атому кислорода, поэтому молекула воды полярна. Более крупный и обладающий большим положительным зарядом атом кислорода притягивает электроны сильнее, чем атомы водорода, поэтому кислородная сторона молекулы имеет определенный отрицательный заряд, а водородная — положительный. Таким образом, высокая диэлектрическая постоянная воды (80,37 при 20°С) обусловлена полярностью молекул (Handbook of Chemistry and Physics, 1969).
Многие аномальные свойства воды являются следствием большого числа водородных связей между ее молекулами или кристаллами льда. Молекулы соединений, в которых водород ковалентно связан с такими высокоэлектроотрицательными элементами малого размера, как кислород, фтор и азот, образуют прочные межмолекулярные связи. В таких молекулах электроотрицательные атомы проявляют сильное сродство к электрону, в результате чего атом водорода приобретает эффективный положительный заряд. Положительно заряженный водород стремится притянуть электроны другого атома, в результате чего образуется водородная связь. Высокая прочность водородных связей из-за отсутствия экранирующих электронов и малого размера атома приводит к тому, что атом водорода притягивает электроотрицательную молекулу. Во льду каждый атом водорода образует одну водородную связь с атомом кислорода. Образующаяся в результате кристаллическая структура имеет пустоты, уменьшающие плотность льда. Когда лед начинает таять, некоторые водородные связи разрываются, кристаллическая структура (с пустотами) разрушается и плотность увеличивается. Результатом этого является очень важное свойство: холодная вода тяжелее льда. Еще одно важное следствие наличия водородной связи — аномально высокие значения точки кипения, теплоты парообразования, теплоты плавления и вязкости.
Жесткость
Имеющиеся в большинстве руководств и справочников описания свойств воды относятся в основном к чистой воде, не содержащей примесей. Вода, используемая в системах для культивирования водных организмов, обычно не бывает чистой. В ней содержатся различные растворенные и взвешенные вещества, которые в разной степени могут изменять свойства воды в зависимости от концентрации и собственных химических характеристик. Определение качественного и количественного состава вод каждого источника практически невозможно, так как природные источники весьма отличаются друг от друга, кроме того, концентрации примесей в любом водном источнике могут меняться со временем, поэтому были выбраны определенные параметры, определяющие основные характеристики вод. К ним относятся жесткость, щелочность и соленость.
Понятием жесткости обычно пользуются при характеристике пресных вод. Первоначально под жесткостью понимали способность воды осаждать мыло. В этом процессе обычно участвуют ионы кальция и магния. Ионы алюминия, железа, марганца, стронция, цинка и другие поливалентные ионы, а также ионы водорода тоже могут осаждать входящие в состав мыла компоненты1. Чем жестче вода, тем больше мыла необходимо для получения определенного моющего эффекта. Однако жесткость имеет и более широкое значение. Поскольку в большинстве случаев жесткость воды почти целиком обусловлена присутствием кальция или магния, ее определяют как общую концентрацию этих ионов в виде карбоната кальция. Однако, если ионы других металлов присутствуют в значительном количестве, их также учитывают при определении жесткости.
Под щелочностью воды понимается способность воды принимать протоны (Standard Methods, 1971). Щелочность обычно обусловлена присутствием в природных водах карбонатов, бикарбонатов и гидроксидов. Если жесткость численно превышает суммарную карбонатную и бикарбонатную щелочность, различают карбонатную и некарбонатную жесткость. Карбонатная жесткость эквивалентна общей щелочности, разница между ними представляет собой некарбонатную жесткость. Если жесткость численно равна или меньше суммы карбонатной и бикарбонатной щелочности, то некарбонатная жесткость отсутствует (Standard Methods, 1971).
По классификации геологической службы США природные воды по жесткости делятся на четыре класса. Из табл. 2.1 видно, что в эту классификацию входят только пресные воды.

Методы определения жесткости достаточно известны (Standard Methods, 1971) и в данной работе не рассматриваются.
Соленость
Для характеристики солоноватых и морских вод (в данной книге и те и другие отнесены к соленым водам) необходим параметр, отражающий концентрацию неорганического вещества. Таким параметром может служить соленость. Соленость определяется как общее количество твердого вещества, выделенного из 1 т морской воды, когда все карбонаты превращены в окислы; бром и иод замещены хлором, а органическое вещество полностью окислено. Соленость природных вод может колебаться от 0 до 40‰. Соленость морских вод составляет, как правило, 33—37‰, в среднем примерно 35 ‰. В некоторых закрытых водоемах, таких, как Большое Соленое озеро в штате Юта или Мертвое море, соленость значительно превышает 40‰.
Одним из важнейших законов морской химии является закон постоянства основного солевого состава, который гласит, что отношение концентрации каждого из элементов основного солевого состава к концентрации всего твердого минерального вещества, растворенного в морской воде, остается постоянным. Эта зависимость имеет большое значение, так как позволяет определять соленость по концентрации одного из присутствующих ионов, что значительно упрощает процедуру анализа. Поскольку на долю хлоридов приходится около 55% общего количества растворенных солей, соленость определяют по содержанию хлор-иона. По определению хлорность — это число (в ‰), равное массе серебра в грамм-атомах, необходимой для осаждения галогенов, содержащихся в 0,3285233 кг морской воды. Такое определение позволяет преодолеть трудности, связанные с изменением атомного веса серебра, значение которого неоднократно уточнялось. На практике соленость определяют титрованием определенного объема воды стандартным раствором азотнокислого серебра в присутствии индикатора. Галогены при этом осаждаются, и, когда все они оказываются связанными, цвет раствора изменяется. По количеству азотнокислого серебра можно рассчитать хлорность, а затем с помощью формулы Кнудсена [уравнение (2.1)] по хлорности определить соленость:
где S — соленость, %0; Cl — хлорность, %0.
Фофонов предложил другую формулу, связывающую соленость с хлорностью [уравнение (2.2)]:
Формула Фофонова была получена по данным, аналогичным данным Кнудсена, но в предположении, что морская вода смешана с практически неминерализованной водой. Это позволило освободиться от свободного члена при незначительном увеличении наклона прямой на графике (Tsurikova and Tsurikov, 1971). Поскольку большинство таблиц солености рассчитано по формуле Кнудсена [уравнение (2.1)], она использована и в данной работе2.
Титрование по ряду причин предпочтительнее прямого метода: определения солености выпариванием соленой воды с последующим взвешиванием сухого остатка. Техника выпаривания весьма трудоемка и связана со значительными затратами времени. Для удаления органического вещества необходимо нагреть полученный сухой остаток до температуры 480—500°С. При этом происходят изменения химического состава, а часть солей разлагается. В результате по весу сухого остатка можно получить неверное представление о солености.
Помимо титрования существуют и другие методы определения солености. В настоящее время наиболее широкое распространение получил метод определения солености по электропроводности и температуре воды. Уравнение (2.3) характеризует связь электропроводности R (в мкОм) с соленостью (в ‰) при 15°С (Tsurikova and Tsurikov, 1971):
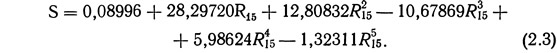
При значениях температуры, отличных от 15°С, в величину измеренной электропроводности необходимо вводить температурную поправку, которая вычисляется по уравнению (2.4) (International Oceanographic Tables, 1966):
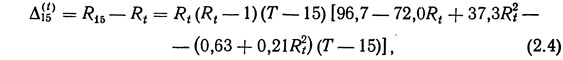
где R15 — электропроводность при 15°С; Rt — электропроводность при температуре Т; Т — температура, °С.
На практике это уравнение используется редко, так как приборы для определения солености (солемеры) оборудованы встроенными автоматическими температурными компенсаторами.
Теоретически, используя изложенные выше методы, можно определить соленость различных вод — от глубинных океанических до пресных. Однако при определении солености эстуарных вод требуется осторожность и тщательность, поскольку в этом случае возможны отклонения от закона постоянства основного солевого состава. Присутствие в водах эстуариев некоторых органических соединений влияет на электропроводность и результаты химического анализа. Все это может привести к ошибкам при определении солености.
Скрытая теплота парообразования
Скрытая теплота парообразования (испарения)—это энергия, необходимая для испарения единицы массы какого-либо вещества при постоянной температуре. Для воды при температуре 100°С и давлении 1 ат скрытая теплота парообразования составляет 2,258 кДж/г (Handbook of Chemistry and Physics, 1958). Столь высокое значение объясняется наличием водородных связей. Каждая молекула воды связана водородными связями с двумя другими молекулами. Чтобы разорвать соответствующее числу Авогадро количество водородных связей (6,0235·1023), необходимо затратить 20,3 кДж энергии. Поскольку каждая молекула имеет две водородные связи, для испарения (разрыва водородных связей) одной грамм-молекулы воды требуется 40,6 кДж. Действительно, если для испарения 1 г воды требуется 2,258 кДж, а масса одной грамм-молекулы воды составляет 18 г, то
Это подтверждает важную роль водородных связей в формировании физико-химических свойств воды.
Скрытая теплота парообразования морской воды такая же, как и пресной. Вещества, попадающие в воду в результате функционирования систем для культивирования водных организмов, практически не влияют на эту характеристику.
Скрытая теплота плавления
Скрытая теплота плавления — это количество теплоты, потребляемое веществом при переходе из твердого состояния в жидкое при постоянной температуре. Скрытая теплота плавления воды 333,6 Дж/г при температуре замерзания 0°С (Handbook of Chemistry and Physics, 1958). При подведении ко льду теплоты движение молекул ускоряется и часть водородных связей разрывается. Чтобы лед превратился в воду, достаточно разорвать 15% водородных свйзей (Reid, 1961). Разрыв оставшихся водородных связей объясняет высокие значения удельной теплоемкости и теплоты парообразования воды.
Примеси, присутствующие в воде, изменяют температуру замерзания, а также непосредственно влияют на скрытую теплоту плавления Увеличение солености приводит к понижению температуры замерзания. Брац (Brahtz, 1968) вывел следующую зависимость между понижением точки замерзания и хлорностью (показателем солености):
где FPL — понижение точки замерзания, °С; Cl — хлорность, ‰.
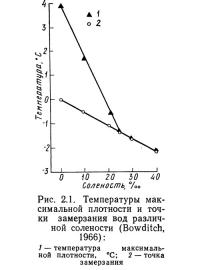
Таким образом, с увеличением солености (или хлорности) температура замерзания морской воды понижается. Брац определил эту зависимость как нелинейную. Боудич (Bowditch, 1966), однако, полагает, что температура замерзания связана с соленостью линейной зависимостью (рис. 2.1). Расхождение весьма незначительно, так как коэффициент при кубическом члене в уравнении (2.5) очень мал.
Органические и неорганические примеси, попадающие в воду, обычно понижают температуру замерзания. Общий эффект зависит от их состава и концентрации в воде. Данные о влиянии на температуру замерзания распространенных водных смесей и растворов содержатся в различных справочниках (например, Handbook of Chemistry and Physics, 1969).
Непосредственное влияние примесей на скрытую теплоту плавления довольно трудно поддается объяснению. Например, теплота плавления морского льда 226 Дж/г при температуре замерзания — 1,7°С (Handbook of Chemistry and Physics, 1958). Если бы уменьшение теплоты плавления полностью определялось понижением точки замерзания, то теплота плавления составляла бы примерно 295 Дж/г. Очевидно, теплота плавления каким-то образом непосредственно связана с наличием примесей.
Удельная теплоемкость
Удельная теплоемкость — это количество энергии, необходимое для повышения температуры единицы массы вещества на один градус. Поскольку калория — это количество энергии, необходимое для нагревания 1 г воды с 14,5 до 15,5°С, удельная теплоемкость воды при постоянном давлении (Ср) равна 1 кал/(г·°С), или 4,186 Дж/(г·°С).
Удельная теплоемкость воды исключительно велика, лишь немногие вещества (среди них аммиак) обладают более высокой теплоемкостью. Добавление примесей уменьшает удельную теплоемкость воды. Брац (1968) установил следующее соотношение между удельной теплоемкостью при постоянном давлении и соленостью морской воды при 0°С и давлении 1 ат:
где Ср — удельная теплоемкость при постоянном давлении, кал/(г·°С); S — соленость, ‰.
Удельная теплоемкость при постоянном объеме может быть вычислена по следующей формуле (Brahtz, 1968):
где Cv — удельная теплоемкость при постоянном объеме; Т — температура, °С; е — коэффициент теплового расширения; ρ — плотность; К1 — коэффициент сжимаемости; J1 — механический эквивалент теплоты.
Высокая удельная теплоемкость воды как среды обитания имеет большое значение. Например, температура воды более постоянна, чем температура воздуха, и изменяется довольно медленно. Это очень важно для процессов фотосинтеза и насыщения воды кислородом. Более подробно значение теплоемкости будет продемонстрировано в следующих главах.
Плотность
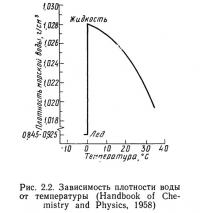
Плотность воды оказывает большое влияние на циркуляцию и круговорот элементов в водных системах. Они в свою очередь воздействуют на биологические организмы, а также играют важную роль в формирования погоды. Плотность воды является функцией температуры (рис. 2.2). Максимальная плотность чистой воды достигается при температуре 3,98°С. В точке замерзания происходит разрыв функции и плотность резко снижается, поэтому лед легче воды и плавает. Если бы плотность воды не зависела от температуры, озера промерзали бы до дна и многие из них полностью никогда не оттаивали бы, что имело бы катастрофические последствия для живых организмов.
Внесение в воду неорганических солей изменяет температуру, при которой достигается максимальная плотность, и температуру замерзания (см. рис. 2.1). С увеличением солености температура, при которой плотность максимальна, снижается до тех пор, пока при солености 24,7 %0 она не совпадает с температурой замерзания.
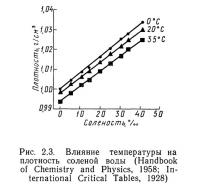
Поскольку соли, взвеси и другие примеси плотнее воды, добавление их к воде приводит к увеличению ее плотности. Например, морская вода соленостью 35 ‰ имеет плотность 1,028 г/см3, в то время как плотность чистой воды 1 г/см3. На рис. 2.3 показано непосредственное влияние температуры и солености на плотность морской воды: с увеличением солености и уменьшением температуры плотность возрастает.
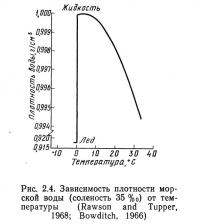
Морская вода имеет наибольшую плотность при температуре замерзания (рис. 2.4). Следовательно, лед, образованный морской водой, должен погружаться и оседать на дне океанов. К счастью, этого не происходит, так как по мере замерзания вода и соли разделяются. Образовавшийся лед почти не содержит солей и поэтому легче морской воды. Воды, находящиеся в непосредственной близости от формирующегося льда, имеют более высокую соленость, чем окружающие, поскольку в них концентрируются выделяющиеся из льда соли.
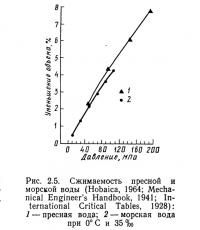
Кроме температуры и солености на плотность воды влияет и давление (рис. 2.5). Как и следовало ожидать, с увеличением давления плотность возрастает. Однако воду можно считать несжимаемой жидкостью (исключение составляют только случаи проведения работ на больших глубинах), так как при давлении 40 МПа ее объем уменьшается всего на 2%. Следовательно, в большинстве работ по аквакультуре воду можно рассматривать как несжимаемую жидкость.
Разность плотностей — основная движущая сила круговорота в пресноводных системах и вертикальной циркуляции в океанах. Поскольку плотность является функцией температуры и солености, эти параметры оказывают большое влияние на среду обитания живых организмов. Роль плотности в водных системах более подробно освещена в последующих главах.
Вязкость
Вязкость воды — это степень сопротивления жидкости сдвигу3. Количественное выражение для вязкости можно получить из рис. 2.6. К пластине 1 приложена сила F, заставляющая ее перемещаться со скоростью v вдоль пластины 2. Пластины 1 и 2 разделены слоем жидкости толщиной у. Силе F противостоит сопротивление жидкости сдвигу. Сила, необходимая для сдвига жидкости, прямо пропорциональна площади жидкости, которую необходимо сдвинуть (эта площадь равна площади пластины 1 на рис. 2.6), и скорости сдвига (предполагая, что жидкость ньютоновская4). Кроме того, чем больше слой жидкости, тем меньшую силу необходимо приложить:
где F — сила; v — скорость движения пластины 1; A — площадь пластины 1; у — толщина слоя жидкости; μ — коэффициент пропорциональности.
Тангенциальное напряжение τ — это сила, приложенная к единице площади:
Подставляя выражение (2.8) в уравнение (2.9), получаем
Скорость сдвига в любой точке слоя часто является функцией у, поэтому отношение v/y в более общем виде записывается в дифференциальной форме dv/dy.
Коэффициент пропорциональности μ называется вязкостью. Вязкость различных жидкостей неодинакова и зависит от температуры жидкости: вязкость патоки больше, чем воды, но горячая патока менее вязкая, чем холодная.
Коэффициент пропорциональности р часто называют динамической или абсолютной вязкостью и выражают в паскаль-секундах (Па·с) или ньютон-секундах на квадратный метр (Н·с/м2). Абсолютная вязкость, деленная на плотность жидкости ρ, называется кинематической вязкостью:
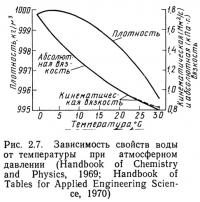
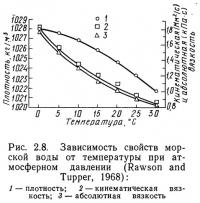
На рис. 2.7 и 2.8 показаны зависимости плотности, абсолютной и кинематической вязкости пресной и морской воды от температуры. Ни один из этих параметров как для пресной, так и для морской воды не связан линейно с температурой. Вязкость увеличивается с понижением температуры. То же самое относится и к плотности, за исключением пресной воды при температуре ниже 3,98°С. Таким образом, при движении в холодной воде рыбе приходится затрачивать больше энергии, чем в теплой (при одинаковой скорости). Кроме того, приведенные выше факторы несколько увеличивают затраты на перекачивание воды при уменьшении температуры, так как одновременно увеличиваются и вязкость, и плотность.
Теплопроводность
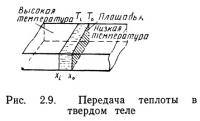
Передача теплоты — это перенос энергии через вещество или комбинацию веществ из области высоких температур в область низких температур. Отсюда легко вывести основной закон передачи теплоты в одну сторону. На рис. 2.9 показано тело с участком высоких температур в левой части и участком низких температур — в правой. Площадь поперечного сечения плоскопараллельной пластины A, ее толщина (xi—x0), разность температур между сторонами пластины Ti—Т0. Поток теплоты через пластину
где Eh — поток теплоты, К — коэффициент пропорциональности; А — площадь.
Поскольку величины Ti—Т0 и xi—x0 могут быть сколь угодно малыми, уравнение (2.12) принимает вид
Коэффициент пропорциональности К называется теплопроводностью и измеряется в ваттах на сантиметр-градус Цельсия [Вт/(см·°С)].
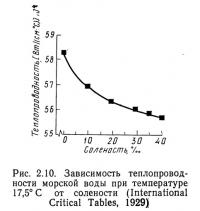
Теплопроводность пресной и соленой воды при температуре 17,5 °С показана на рис. 2.10: с увеличением давления и температуры теплопроводность возрастает (Bowditch, 1966). Теплопроводность водных систем очень низка, поэтому неподвижная вода является хорошим теплоизолятором. Однако поскольку вода постоянно циркулирует, основным способом передачи тепла является конвекция, отодвигающая теплопроводность на второй план. Низкой теплопроводностью и значительным конвективным переносом тепла объясняются многие особенности водных систем, например четко выраженная океаническая циркуляция. Благодаря конвекции океаны действуют как огромные тепловые насосы, передающие энергию от экватора к полюсам.
Поверхностное натяжение
Молекулы, находящиеся на границе между жидкостью и газом или между двумя жидкостями, испытывают неодинаковое притяжение, которое проявляется в виде поверхностного натяжения. Поверхностное натяжение зависит от температуры и солености: с увеличением солености оно возрастает, с увеличением температуры — уменьшается. Зависимость поверхностного натяжения от температуры и хлорности выражается следующей зависимостью (Bowditch, 1966):
где ST — поверхностное натяжение, дин/см или 10—5 Н/см; Т — температура, °С; Cl — хлорность, ‰.
Подставив выражение (2.1) в уравнение (2.14), можно непосредственно связать поверхностное натяжение с соленостью:
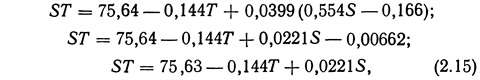
где S — соленость, ‰.
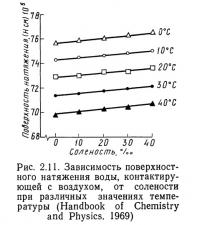
Уравнение 2.15 показывает, что поверхностное натяжение возрастает с увеличением солености и понижением температуры, причем температура влияет на него в большей степени, чем соленость (рис. 2.11).
Поверхностное натяжение играет важную роль в водных системах; так как с этим параметром тесно связана аэрация: от величины поверхностного натяжения зависит размер пузырьков, который в свою очередь определяет эффективность пузырьковых аэраторов и пеноотделителей.
Концентрация ионов водорода
Концентрация ионов водорода обычно выражается величиной pH:
где [Н+] — концентрация ионов водорода.
При pH 7 среда считается нейтральной, при меньших значениях— кислой, при больших — щелочной. От pH зависят константы диссоциации многих химических реакций, происходящих в водных растворах. Таким образом, pH оказывает большое влияние на химическую среду, в которой обитают водные организмы. Например, с увеличением pH равновесие между NH+4 и NH3 в водной среде сдвигается в сторону образования NH3. Для большинства видов рыб NH3 — высокотоксичное вещество. Для одного и того же вида рыб вода с pH 6,5 совершенно безопасна, в то время как при pH 8 она становится высокотоксичной. Если величина pH очень значительно отличается от нейтральной, то вода сама по себе может стать токсичной для большинства гидробионтов. Величина pH определяет также доступность двуокиси углерода для водных организмов.
В водах озер pH изменяется от 6 до 9, но под влиянием вулканических кислот может уменьшиться до 1,7. Если питающие озеро ручьи текут по известковым отложениям, pH может превышать 9 (Reid, 1961). В океанах pH поверхностных вод обычно находится в пределах 7,8—8,3, причем наиболее высокие значения наблюдаются в субтропических водах. Величина pH мало изменяется благодаря большой буферной емкости океанических систем (Sverdrup et. al., 1942).
Давление насыщенного пара
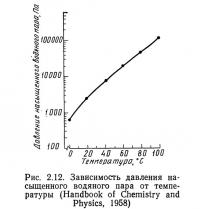
Давление насыщенного пара — это давление, которое оказывает газообразная фаза вещества, находящаяся в равновесии с твердой или жидкой фазой. Давление насыщенного пара чистой воды является функцией температуры (рис. 2.12) и снижается при добавлении в воду солей. Зависимость давления насыщенного пара от хлорности выражается следующим выражением (Brahtz, 1968):
где VP — давление насыщенного пара соленой воды; (VP)0 — давление насыщенного пара чистой воды при той же температуре; Cl — хлорность, ‰.
Подставляя уравнения (2.1) в уравнение (2.17), можно связать давление насыщенного пара непосредственно с соленостью:
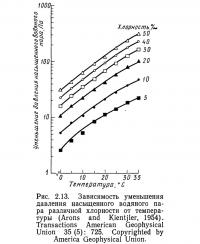
Давление насыщенного пара соленой воды можно вычислить но уравнению (2.17) или (2.18). Однако без калькулятора выполнение этих расчетов довольно трудоемко. Процедура вычислений значительно упрощается при использовании графиков, приведенных на рис. 2.12 и 2.13. Прежде всего определяют температуру. Затем, восстановив перпендикуляр из точки на оси абсцисс (см. рис. 2.12), соответствующей данной температуре, до пересечения с линией графика, проводят горизонтальную линию до оси ординат и снимают значение давления насыщенного пара для чистой воды (VP)0. После этого на рис. 2.13 от значения известной температуры проводят вертикальную линию до пересечения с линией графика соответствующей хлорности. Из этой точки проводят горизонтальную линию до пересечения с осью ординат и получают значение уменьшения давления насыщенного пара VPL для данной пробы. Давление насыщенного пара затем вычисляют по уравнению
Переход от солености к хлорности и обратно, необходимый для пользования графиком на рис. 2.13, может быть выполнен с помощью уравнения (2.1).
Осмотическое давление
Если разделить полупроницаемой мембраной два водных раствора с различным содержанием соли, то вода под воздействием осмотических сил будет проникать сквозь мембрану из камеры с меньшим содержанием соли в камеру с большим ее содержанием. Если камера с большей концентрацией соли закрыта и она находится под давлением, то оно вызовет движение воды сквозь полупроницаемую мембрану из области высокого давления в область низкого. При этом будет достигнуто такое положение, когда поток воды, вызванный внешним физическим давлением, будет равен потоку в противоположном направлении, вызванному осмотическими силами. Значение приложенного физического давления в этот момент равновесия будет соответствовать значению осмотического давления. Осмотическое давление — это давление, которое необходимо приложить для предотвращения проникновения воды сквозь полупроницаемую мембрану при различных концентрациях соли по разные стороны от мембраны.
Осмотическое давление соленой воды при 0°С может быть вычислено по следующему уравнению (Brahtz, 1968):
где (ОР)0 — осмотическое давление при 0°С, Па·105; FPL — понижение точки .замерзания, °С.
При температурах, отличных от 0°С, осмотическое давление можно рассчитать по уравнению (2.21)
где (ОР)t — осмотическое давление (Па·105) при температуре Т (°С).
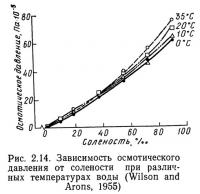
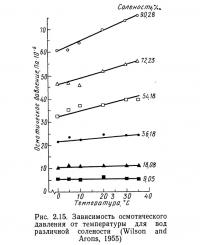
И температура, и соленость влияют на величину осмотического давления. На рис. 2.14 показана зависимость осмотического давления от солености при различных значениях температуры, а на рис. 2.15 — от температуры при различных значениях солености. Наклон линий на рис. 2.14 больше, чем на рис. 2.15, что свидетельствует о большем по сравнению с температурой влиянии солености на осмотическое давление.
Биологические организмы (точнее, их внешняя оболочка) представляют собой полупроницаемые мембраны по отношению к окружающей их водной среде. Содержание солей в организмах отличается от их содержания в водной среде, поэтому гцдробионтам приходится затрачивать энергию для поддержания собственного солевого баланса. Эти затраты изменяются при передвижении организмов в водах различной солености. Слишком быстрые или значительные изменения во внешней среде могут потребовать энергии, которую организм не в силах выработать, результатом чего может быть его гибель. Осмотическое давление — основной критерий, по которому организмы разделяются на пресноводные и морские.
Прозрачность
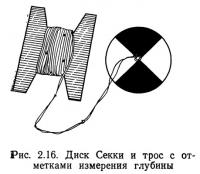
Прозрачность воды в естественных водоемах изменяется от значительной до практически равной нулю. Она зависит от типа, размера и количества взвешенных частиц, концентрации и химических свойств растворенных веществ, а также от длины волны, интенсивности и угла падения солнечного света. Прозрачность обычно измеряется либо с помощью диска Секки, либо прибором типа спектрофотометра, который позволяет определять количество света, поглощенного пробами воды.
Диаметр белого или черно-белого диска Секки обычно составляет 30 см. Он прикреплен к тросу, по всей длине которого через каждый метр сделаны отметки (рис. 2.16). Для определения прозрачности диск опускают за борт, постепенно погружая его в толщу воды. В тот момент, когда глаз перестает различать диск, производят отсчет глубины. Для прибрежных вод прозрачность по диску Секки может изменяться от нескольких сантиметров до 25 м. Значения прозрачности для открытого океана обычно составляют 45—60 м. Самая большая глубина, на которой диск Секки становится неразличимым, равна 66 м и зарегистрирована для Саргассова моря (Bowditch, 1966). Для пресноводных озер значения прозрачности по диску Секки составляют от 40 м до близких к нулю (Reid, 1961).
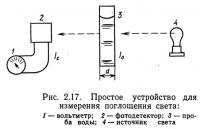
Диск Секки позволяет определить относительную прозрачность, значения которой можно сравнивать для различных водоемов. Количественные измерения производятся при помощи приборов типа спектрофотометров. Простейшая схема измерения поглощения света приведена на рис. 2.17. В нее входят источник света, исследуемая проба воды толщиной d, фотодетектор и вольтметр. Свет от лампы проходит через столб воды, а затем попадает на фотодетектор. Электрический сигнал на выходе фотодетектора пропорционален интенсивности падающего на него света. Поглощение света в этом случае математически выражается законом Ламберта:
где I0 — интенсивность света, падающего на пробу воды; Iz — интенсивность света, прошедшего через воду; k — коэффициент поглощения, е — основание натуральных логарифмов; d — толщина пробы воды.
Уравнение (2.22) может быть использовано для определения значения k, но так как k зависит от длины волны падающего света, значение длины волны также должно быть указано. Поскольку Iz измеряется фотодетектором, I0, d не известны, может быть вычислен k. Однако величина k не определяет мутность воды.
Уравнение (2.22) может быть приведено к следующему виду:
где m — коэффициент ослабления; d — толщина пробы воды; с — концентрация взвешенного вещества по сухому весу.
Iz и I0 определяются так же, как в уравнении (2.22). Сравнивая уравнения (2.22) и (2.23), получаем
Преимущество уравнения (2.23) заключается в том, что оно позволяет выделить влияние концентрации взвеси среди прочих параметров. С помощью уравнения (2.23), используя предварительно полученные в лаборатории значения m и измеряя в полевых условиях Iz/I0 и глубину d, можно определять концентрации растворенных и взвешенных веществ. Однако этот метод имеет один существенный недостаток. Поглощение взвешенных или растворенных в воде веществ зависит от длины волны и интенсивности падающего света, поэтому в пробах, используемых для калибровки приборов, должны содержаться те же примеси, концентрации которых определяются в полевых условиях, и во всех анализируемых пробах должны содержаться примеси одного типа. Если эти условия не соблюдаются, в результате наблюдений необходимо вносить поправки.
Цвет
Цвет воды — это результат взаимодействия падающего света с содержащимися в ней примесями. Чистая вода, освещенная солнечным светом, кажется синей, поскольку синий свет проникает глубже и больше рассеивается водой. Отражение от облаков изменяет кажущийся цвет воды. Цвет воды меняется в зависимости от физической природы и химического состава присутствующих в ней примесей. Зеленые водоросли окрашивают воду в зеленый цвет. Взаимодействие синего рассеянного света и зеленого цвета водорослей дает сине-зеленую окраску, характерную для вод Ка-рибского моря. Частицы почвы часто придают воде красноватый оттенок.
Поскольку цвет и прозрачность воды зависят от наличия примесей, а также от пропускания и отражения света водной средой, между этими параметрами существует тесная взаимозависимость. Воды с высокой биологической продуктивностью имеют низкую прозрачность, а их цвет определяется цветом преобладающих видов фитопланктона. Воды с низкой биологической продуктивностью обычно синие и очень прозрачные, поскольку их цвет определяется в значительной степени рассеянием света самой водой. Цвет воды в таких высокопродуктивных водоемах, как водоемы прудовых хозяйств, определяется фитопланктоном. Опытные рыбоводы по цвету воды часто определяют ее качество. Например, изменение цвета прудовой воды может указывать на возможность дефицита кислорода. Таким образом, информация о причинах, вызывающих изменение цвета и прозрачности воды, может быть с успехом использована для определения условий разведения водных организмов.
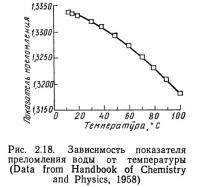
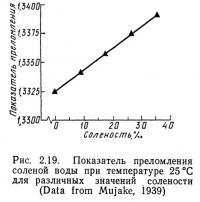
Показатель преломления
Показатель преломления воды зависит от ее температуры и солености. На рис. 2.18 представлена зависимость показателя преломления воды от температуры, а на рис. 2.19 — влияние солености на показатель преломления воды при температуре 25°С. Эта зависимость описывается уравнением
где N25 — показатель преломления воды при 25°С.
Показатель преломления определяет изменение направления света и, следовательно, косвенно влияет на цвет воды. Выше уже отмечалось значение цвета воды для установления условий жизнедеятельности биологических организмов. С помощью рефрактометра высокой точности и уравнений (2.24) и (2.1) можно рассчитать соленость. Однако, поскольку оборудование для определения электропроводности в настоящее время дешевле, на практике обычно предпочитают этот метод определения солености.
Заключение
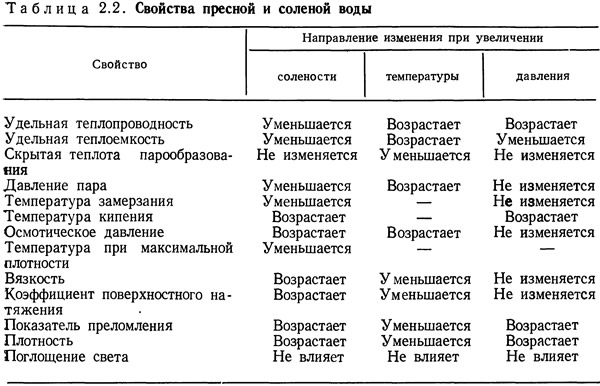
В главе 2 рассматривались свойства пресной и соленой воды и их влияние на условия разведения и выращивания водных организмов. Эти свойства сведены в табл. 2.2.
Список литературы
- Arons, А. В. and С. F. Kientjler (1954). Vapor Pressure of Seasalt Solutions. Transactions of the American Geophysical Union 35 (5): 722—728.
- Bowditch (1966). Oceanography, Part 6 of American Practical Navigator, H. O. Publication No. 9—Part 6, U. S. Navy Hydrographic Office.
- Brahzt, J. T. (1968). Ocean Engineering. Wiley, New York.
- Handbook of Chemistry and Physics, C. D. Hodgman, Ed. (1958). Chemical Rubber Publishing Company, Cleveland.
- Handbook of Chemistry and Physics, 50th ed., R. C. Weast, Ed. (1969). Chemical Rubber Publishing Company, Cleveland.
- Handbook of Tables for Applied Engineering Science, R. E. Bolz and G. L. Tuve, Eds. (1970). Chemical Rubber Company, Cleveland.
- Hobaica, E. D. (1964). Buoyancy Systems for Deep Submergence Structures. Naval Engineers Journal 75 (5): 733—741.
- International Critical Tables of Numerical Data, Vol. 3 (1928). McGraw—Hill, New York.
- International Critical Tables of Numerical Data, Vol. 4 (1928). McGraw— Hill, New York.
- International Critical Tables of Numerical Data, Vol. 5 (1929). Mc.Graw*-Hill, New York.
- International Oceanographic Tables (1966). National Institute of Oceanography of Great Britain and UNESCO, London.
- King D. A. (1969). Basic Hydrodynamics, Section 2 in Handbook of Ocean-and Underwater Engineering, J. J. Myers, Ed. McGraw—Hill, New York.
- Mechanical Engineers’Handbook. L. S. Marks, Ed. (1941). Me Graw—Hill, New York.
- Mujake, Yasso (1939). Chemical Studies of the Western Pacific Ocean. IV. The Refractive Index of Seawater. Bulletin of the Chemical Society of Japan 14 (6); 239—242.
- Rawson, K. J. and E. C. Tupper (1968). Basic Ship Theory. American Elsevier, New York.
- Reid, George K. (1961). Ecology of Inland Waters and Estuaries. Reinhold,. New York.
- Semioli, W. J. and P. B. Schubert (1974). Conversion Tables for SI Metri-fication. Industrial Press, New York.
- Sverdrup, H. U., Martin W. Johnson, and Richard H. Fleming (1942). The-Oceans—Their Physics, Chemistry and General Biology. Prentice—Hall, Englewood Cliffs, N. J.
- Standard Methods for the Examination of Water and Wastewater, 13 th ed. (1971). American Public Health Association, Washington, D. C.
- Tsurikova, A. P. and V. L. Tsurikov (1971). On the Concept of «Salinity»-Oceanology 11 (2): 282—285.
- Wilson, K. G. and A. B. Arons (1955). Osmotic Pressures of Seawater Solutions Computed from Experimental Vapor Pressure Lowering. Journal of Marine Science 14(2): 195—198.
Примечания
1. Ионы водорода нейтрализуют щелочи мыла, а не осаждают его компоненты.
2. Кроме того, предположение Фофонова неприменимо для процессов смешения морских и речных вод.
3. Сдвигом называется такое движение, при котором плоскости жидкости, параллельные элементу поверхности, скользят, как жесткие, друг над другом.
4. Ньютоновская жидкость — это такая жидкость, для которой точно выполняется линейное соотношение между напряжением и деформацией.