Многочисленные исследования биохимического механизма кальцификации и участие в нем зооксантелл пока не дали однозначного ответа. Разными авторами предполагались разные схемиг механизма этого процесса (Muscatine, 1971). Одни авторы считают, что в процессе фотосинтеза зооксантеллы удаляют из зон кальцификации в тканях животного кислые продукты обмена (СО2, органические кислоты), способствуя под-щелочению среды, а также удаляют фосфаты и аммоний — вещества, тормозящие кристаллизацию СаСО3 (Goreau, 1963; Yonge, 1968; Yamazato, 1970; Woodhead, Weber, 1973; Crossland, Barnes, 1974). Согласно другим представлениям, зооксантеллы поставляют исходные органические молекулы для синтеза органической матрицы типа хитиновых волокон, которые являются как бы ядрами кристаллизации (Wainwright, 1963; Young, 1973; Johnston, 1979). Еще одна точка зрения на участие фотосинтеза зооксантелл в процессе кальцификации сводится к тому, что последние поставляют тканям коралла энергетический материал, необходимый для компенсации затрат энергии на кальцификацию, поскольку он может была связан с энергозависимгми процессами транспорта ионов Са2+ и бикарбоната через клеточные мембраны (Yamazato, 1970; Barnes, Taylor, 1973). Существующие экспериментальные данные показывают, что азотистые соединения цитруллинового цикла (мочевина, аллантоин) участвуют в процессе кальцификации у кораллов, поставляя в зоны осаждения кальция СО2 и ионы NH3+, которые нейтрализуют протоны при образовании СаСО3 (Crossland, Barncs, 1974). Кораллы откладывают известь в виде кристаллов арагонита, хотя в их колониях можно встретить и кристаллы кальцита. Они появляются в них вторично в результате кристаллизации карбоната кальция в ходах сверлящих организмов (Macintyre, Towe, 1976).
Скорость кальцификации у кораллов измеряют по весовому или объемному приросту скелета (Jokiel et аl., 1978), по потреблению ионов Са+ из морской воды (Stoddart, Joharnes, 1978), по балансу углекислоты в воде, измеряемому путем определения рН воды (Barnes Deveraux, 1984). Однако чаще всего используют радагоизотопный метод Горо (Goreau, 1959; 1963). Кальцификация измеряется по интенсивности потребления иона Са2+, содержащего радиоактивный кальций Са4 5 (Drew, 1973; Barnes, Crossland, 1978; Bohm, 1978).
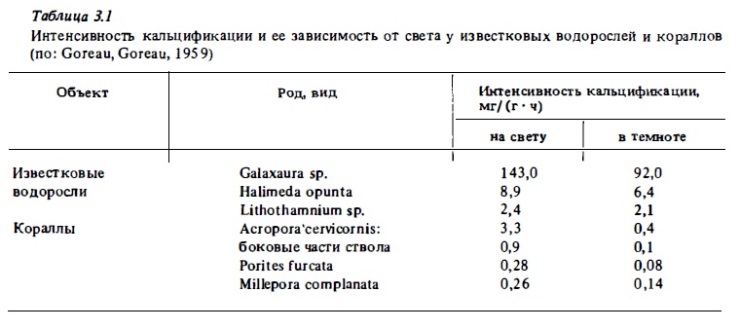
Опыты по измерению скорости кальцификации кораллов in situ показали, что суточный ход этого процесса сходен с ходом кривой валового фотосинтеза кораллов. Измерения световых кривых кальцификации (зависимость скорости процесса от освещенности) показали их сходство со световыми кривыми фотосинтеза кораллов (Barnes, Taylor, 1973). Эти данные дали возможность описать упомянутую зависимость в виде уравнения:
C=Cm·tgJ/Jk,
где С — наблюдаемая интенсивность кальцификации,
Cm— максимальная ее интенсивность,
J — наблюдаемая освещенность,
Jk — оптимальная освещенность (Chalker, 1983).
Ввиду существования такой зависимости следует ожидать заметного снижения интенсивности кальцификации и соответственно интенсивности роста кораллов с глубиной пропорционально убьти подводной освещенности. В какой-то мере это имеет место (Buddemeycr et аl., 1974; Dustan, 1975). Однако до глубины 20 м эффект снижения скорости роста кораллов, отражающий интенсивность кальцификации, был значительно меньше падения самой освещенности, что достаточно четко доказьшает их световую адаптацию (Barnes, Taylor, 1973). Но световая адаптация действует лишь до определенного предела падения освещенности с глубиной. Например, на рифах Ямайки, согласно классическим исследованиям Горо (Gorcau, 1963), глубже 20 м скорость роста кораллов замедляется, что было подтверждено последующими наблюдениями (Huston, 1985).
В числе животных-обитателей рифа, в большом количестве образующих карбонатный материал, следует выделить фораминиферы. Эти простейшие, обладающие известковым панцирем, достигают в донных осадках рифов огромных размеров — 5-8 мм. При этом крупные и быстрорастущие их виды содержат симбиотические зооксантеллы, наличие которых ускоряет у них кальцификацию и рост. Такие крупные фораминиферы объемом 0,2-0,5 см3 вырастают-за 2-3 года (Ross, 1972; 1977), тогда как мелкие (на 2-3 порядка меньшего объема) донные фораминиферы умеренных морей, также имеющие растительные симбионты, но не зооксантеллы, а синезепсные водоросли, достигают своих максимально размеров за срок 5-6 лет. Найдено, что у герматипньи фораминифер кальцификация зависит от света так же, как у кораллов (Duguay, Taylor, 1978). Фораминиферы в массе развиваются в рьнльи донньи осадках рифа. Раковинки крупный, герматипньи видов фораминифер, и прежде всего фораминиферы Margi-nopora и Alveolinella, формируют около 15% всей массы рьилых осадков рифа (Maxwell, 1968).
Среди моллюсков главными рифостроителями являются тридакны — крупные герматипные моллюски, имеющие симбиотические зооксантеллы. Они дают очень высокую численность на рифах и обладают крупными массивными раковинами. Их раковины достигают метра в длину и имеют вес до сотни килограммов. Раковины тридакн в большом количестве встречаются в составе скальной основы современньи диейстоценовьп рифов (Chappel, Polach, 1976). Изучение механизма кальцификации у моллюсков показало, что в этом процессе большую роль играет особое органическое вещество типа глюкопротеина, секретируемое мантией в полость между раковиной и стенкой растущей раковины (Wilbur, 1976).
Заметную роль в образовании известкового материала играют и агерматипные животные, имеющие известковые скелеты в виде панцирей, игл, трубок, раковин, радул, спикул (Chave et al., 1972, Maxwell, 1973; Cuffey, 1977). В их числе иглокожие (ежи, звезды, офиуры, голотурии), разнообразные моллюски, мшанки, крабы, полихеты, губки и мягкие кораллы.