Устройство фильтра
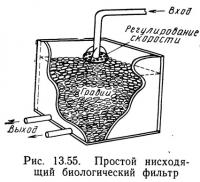
Биологический фильтр обычно представляет собой пористый твердый слой, в котором содержатся нитрифицирующие бактерии. Бактерии извлекают необходимые им питательные вещества и кислород из воды, протекающей через фильтрующий слой. Простой биологический фильтр представляет собой ящик, наполненный гравием. Вода поступает сверху, протекает через фильтрующий слой и вытекает через дренажные трубы на дне ящика (рис. 13.55).
Существует несколько типов биологических фильтров. Погружные фильтры типа показанных на рис. 13.55 — это фильтры, у которых фильтрующий слой полностью погружен в воду. Погружные фильтры подразделяются на нисходящие и восходящие в зависимости от направления тока воды. В нисходящем фильтре вода поступает сверху и вытекает снизу, а в восходящем фильтре поток воды направлен снизу вверх. Иногда применяют также погружные фильтры с горизонтальным током воды. Капельные фильтры — это биологические фильтры, в которых уровень воды поддерживается ниже дна фильтра. Вода поступает сверху и образует водяную пленку на поверхности твердой фазы, но не заполняет пор между частицами фильтрующего слоя. Это обеспечивает нисходящий поток воды и естественную аэрацию в результате прохождения воздуха через фильтр.
Наиболее эффективными являются, по-видимому, восходящие погружные и капельные фильтры. В капельных фильтрах поступление кислорода обеспечивается естественной конвекцией воздуха, и фильтры засоряются твердыми веществами. Однако продолжительность удерживания можно регулировать только путем увеличения толщины фильтрующего слоя. Восходящие затопленные фильтры меньше других погружных фильтров засоряются твердыми веществами. Они позволяют также регулировать продолжительность удерживания в широком диапазоне путем изменения скорости протекания воды.
Реакции и кинетика
Нитрификация является двухэтапным процессом превращения аммония (NH+4) в нитриты (NO-2), а нитритов в нитраты (NO-3). Первый этап этого процесса (превращение NH+4 в NO-2) осуществляется автотрофными бактериями рода Nitrosomonas, которые в присутствии кислорода способны окислять аммоний до NO-2, используя в качестве источника энергии приблизительно 270 кДж/моль (McHarness and McCarty, 1973):
На втором этапе процесса нитрификации при окислении нитритов до нитратов выделяется примерно 73 кДж/моль (McHarness and McCarty, 1973). Эта реакция осуществляется бактериями рода Nitrobacter, которые используют выделяющуюся энергию на процессы обмена веществ:
Реакции (13.58) и (13.59) требуют значительного количества кислорода. Станкевич (Stankewich, 1972) подсчитал, что стехиометрическая потребность в кислороде для превращения NH3—N в NO2—N составляет 3,43 кг кислорода на 1 кг окисленного NH3—N. Превращение NO2—N в NO3—N требует 1,14 кг кислорода на 1 кг окисленного NO2—N. Таким образом, превращение 1 кг NH3—N в NO3—N требует 4,57 кг кислорода. Поскольку для работы биологического фильтра необходимо, по крайней мере, стехиометрическое количество кислорода, то поступление кислорода может стать фактором, ограничивающим нитрификационные процессы, протекающие в биофильтре.
Уравнения (13.58) и (13.59) описывают химические реакции, используемые бактериями Nifrosomonas и Nitrobacter для получения энергии. Бактерии утилизируют эту энергию, углекислый газ и кислород для продуцирования органических соединений, необходимых для роста клеток и обмена веществ. Объем массы клеток, образуемой растущими бактериями, имеет большое значение для биологических фильтров, поскольку отмирающие бактерии образуют взвешенные в воде частицы, которые закупоривают фильтр, что приводит к образованию в нем анаэробных участков, большим потерям напора протекающей через фильтр воды и другим нежелательным последствиям.
Реакции нитрификации — ассимиляции для нитрифицирующих бактерий описываются следующими уравнениями (Anon, 1971):
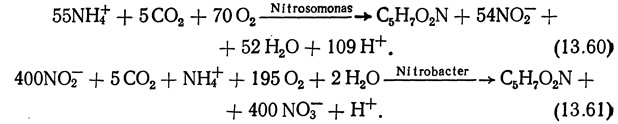
Исходя из этих уравнений, при окислении 1 кг NH3—N до NO2—N образуется 147 г клеток Nitrosomonas и 20 г клеток Nitrobacter. К счастью, по сравнению с гетеротрофными бактериями нитрифицирующие бактерии продуцируют небольшую массу клеток на массу окисленного субстрата, и благодаря этому фильтры не так засоряются, если количество органических веществ, поступающих на нитрификационный фильтр, сведено к минимуму.
Мид (Meade, 1974), основываясь на работе Хога и Маккарти (Haug and McCarty, 1971), приводит следующее уравнение для реакции синтеза клеток автотрофных организмов:
В этой реакции углекислота частично обеспечивает потребность в кислороде, являясь также источником углерода.
Для описания реакций синтеза клеток и метаболических потребностей нитрифицирующих бактерий Мид (1974) предложил уравнения, которые основаны на коэффициентах выхода, вычисленных Хогом и Маккарти (1971):
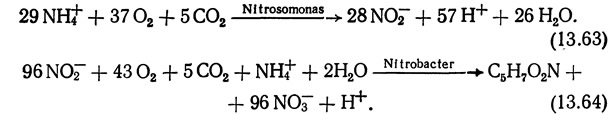
Исходя из этих уравнений, Nitrosomonas потребляет 3,02 кг кислорода на каждый килограмм NH3—N, окисленный до NO2—N, a Nitrobacter — 1,02 кг кислорода на килограмм NO2—N, окисленный до NO3—N. Таким образом, общее потребление кислорода составляет 4,04 кг на килограмм NH3—N, окисленный до NO3—N. Однако, поскольку это отношение зависит от возраста культуры, количество кислорода, необходимое для полного окисления 1 кг NH3—N до NO3—N, составляет от 4 до 4,6 кг.
Уравнения (13.60) и (13.61) аналогичны уравнениям (13.63) и (13.64), за исключением коэффициентов. Следует помнить, что уравнения (13.60) и (13.61) описывают синтез клетки, связанный с окислением NH3—N до NO2—N, тогда как уравнения (13.63) и (13.64) описывают синтез и обмен веществ клетки.
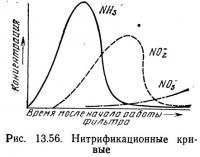
На рис. 13.56 показана зависимость между содержанием аммиака, нитритов и нитратов на начальном этапе работы биологического фильтра. В начале работы популяция нитрифицирующих бактерий либо малочисленна, либо отсутствует вовсе, поэтому посадка рыбы в систему приведет к быстрому увеличению концентрации аммиака в воде. Этот момент является критическим, так как даже низкие концентрации аммиака могут оказаться губительными для культивируемых организмов. Снижение концентрации аммиака обычно сигнализирует о появлении жизнестойкой? популяции Nitrosomonas, превращающей аммиак в нитриты. Однако такое предположение может привести к опасной самоуспокоенности. Обычно в биологическом фильтре присутствуют как. гетеротрофные, так и автотрофные (нитрифицирующие) бактерии.. Гетеротрофные бактерии характеризуются более ускоренным временем генерации (т. е. временем роста, размножения и продуцирования многочисленной популяции), чем автотрофные бактерии,-поэтому гетеротрофные бактерии, которые используют источник: простого органического углерода, но нуждаются в неорганическом азоте для обмена веществ, первоначально становятся доминирующими в фильтре и утилизируют продуцируемый в системе аммиак. Снижение содержания органического углерода подавляет рост гетеротрофных бактерий. Следовательно, первоначальное снижение концентрации аммиака может указывать не на нитрификацию, а на присутствие многочисленной популяции гетеротрофных бактерий. К счастью, это не часто наблюдается в аквакультуре.
Увеличение популяции Nitrosomonas приводит к возрастанию концентрации нитритов, которая достигает максимума, а затем начинает снижаться по мере роста популяции Nitrobacter, превращающей нитриты в нитраты. Увеличение концентрации нитритов также представляет опасность, так как они токсичны для рыб и многих других водных организмов. Систематический контроль за концентрацией нитритов и аммиака позволяет убедиться в том,, что идет процесс нитрификации.
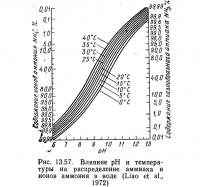
В любой водной системе аммиак присутствует в форме NH4^ и NH3, поскольку между этими двумя формами в воде существует равновесие. Неионная форма (NH3) токсична для большинства водных организмов в концентрациях 1 мг/л и ниже. Особенно чувствительны к NH3 лососи, на которых неблагоприятное воздействие оказывает длительное пребывание в воде с концентрацией NH3 0,006 мг/л (Burrows, 1964). Равновесие между NH3 и NH+4 зависит от pH (рис. 13.57). При pH менее 7 концентрация NH3 невелика и риск токсичности снижается. При более высоких значениях pH токсичность NH3 возрастает. Следует отметить, что в системах с соленой морской водой pH обычно составляет от 7,5 до 8,3, а в пресноводных — от 6,5 до 7,8.
В результате нитрификаций [уравнение (13.58)] и синтеза [уравнения (13.63) и (13.64)] образуются ионы водорода, поэтому во время нитрификации pH, как правило, снижается. В водных растворах ионы водорода нейтрализуются ионами бикарбоната в: воде (при pH менее 8,5) (Haug and McCarty, 1971):
Конечным результатом уравнения (13.65) является снижение концентрации бикарбоната и увеличение содержания углекислоты, а оба эти условия способствуют снижению pH. Хог и Маккарти (1971) подсчитали, что на нейтрализацию ионов водорода, образующихся при окислении 1 кг NH3—N, идет примерно 7,13 кг бикарбоната в виде СаСО3. Расчеты с учетом равновесия угольной кислоты в пресной воде показывают, что если вся углекислота, образующаяся во время нейтрализации, остается в растворе, а pH должен быть выше 6,0, то количество NH3—N (в мг) на литр, которое может быть окислено, равно примерно 0,1 щелочности, выраженной в CaC03 (Haug and McCarty, 1971). Однако в большинстве замкнутых систем происходит частичное удаление углекислоты (например, в процессе аэрации), и обычно наблюдается некоторое снижение pH, поэтому правило «0,1 щелочности» дает консервативную оценку. Тем не менее для поддержания pH на необходимом уровне в воду с низкой щелочностью обычно необходимо добавлять карбонат или бикарбонат. Это часто осуществляется путем использования в качестве фильтрующего слоя карбонатных пород.
pH системы оказывает также непосредственное влияние на нитрифицирующие бактерии. По вопросу о влиянии pH на скорость окисления нитрифицирующими бактериями существуют различные мнения. Хог и Маккарти (1971) обнаружили, что скорость окисления NH3—N неадаптированными культурами была постоянной только при pH 6,8—8. При pH ниже 6,8 скорость окисления NH3—N быстро уменьшалась с понижением pH. Для pH выше 8 опыты не проводились. Энгл и Александер (Engle and Alexander, 1958) наблюдали для Nitrosomonas europaea постоянную скорость окисления в диапазоне pH от 7,5 до 9, а Майерхоф (Myerhof, 1916) — то же для бактерий Nitrosomonas, только в диапазоне от 8,5 до 8,8. Все данные, за исключением данных Майерхофа, свидетельствуют о том, что, по-видимому, наибольшую и относительно постоянную скорость окисления бактерии Nitrosomonas имеют при pH от 7 до 9. Однако Хог и Маккарти (1971) показали, что с течением времени фильтры могут аккли-мироваться к более низким значениям pH. Они продемонстрировали, что через 10 дней после снижения pH до 6 бактериальная скорость окисления NH3—N до NO2—N была равна скорости, наблюдавшейся в оптимальных пределах pH. Однако снижение pH до 5,5 создало условия, к которым нитрифицирующие бактерии не смогли адаптироваться даже с течением времени.
По вопросу о толерантности Nitrobacter к колебаниям pH имеется, по-видимому, меньше данных. Майерхоф (1916) обнаружил, что Nitrobacter осуществляли окисление с наибольшей скоростью только при pH от 8,4 до 9,2. Данные по очистке бытовых стоков (Nitrification and Denitrification Facilities, 1973) показывают, что оптимальные скорости окисления наблюдались в области pH от 8,4 до 8,6. Дудлз и Ричардсон (Duddles and Richardson, 1973) сообщают об удалении 80—90% NH3—N из городских стоков с помощью капельного фильтра с пластмассовым наполнителем при pH 7—8. Опыт работы с нитрифицирующими фильтрами в рыбоводстве свидетельствует о том, что скорость превращения NO2—N в NO3—N достаточно высока для поддержания приемлемо низких концентраций NO2—N при pH 6,5—8,5 (Wheaton, 1973; Lomax, 1975).
Температура также влияет на «скорость нитрификации в биологических фильтрах. С понижением температуры скорость реакции уменьшается. Поскольку температура является одним из расчетных параметров, ее влияние рассмотрено ниже, в разделе «Расчет биологических фильтров».
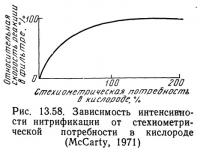
Хог и Маккарти (1971) показали, что при условии обеспечения стехиометрических потребностей в кислороде скорость нитрификации не зависит от концентрации кислорода. Однако при концентрациях кислорода ниже стехиометрических потребностей скорость реакции быстро уменьшается (рис. 13.58).
Расчет биологических фильтров
Существует, по крайней мере, две методики расчета биологических фильтров. Одна из них разработана Лиао и Майо (Liao and Mayo, 1974) с использованием результатов работ других исследователей и собственных данных Вторая методика расчета, также основанная на результатах других исследователей и самого автора, опубликована Списом (Speece, 1973). Хотя работы Лиао и Майо (1974) и Списа (1973) не дают возможности получить полное представление об обоснованности их методик, тем не менее совершенно очевидно, что обе они базируются на небольшом количестве данных, относящихся главным образом к работам с форелью и лососем (холодолюбивые пресноводные виды), и могут иметь лишь ограниченное применение. Какой-либо общей системы расчетных уравнений для биологических фильтров, по-видимому, не существует, поэтому данный раздел нельзя считать исчерпывающим, хотя в нем содержатся наиболее ценные данные, имеющиеся по этому вопросу.
Имеется ряд уравнений, широко используемых для расчета погружных и капельных нитрифицирующих фильтров для городских станций очистки воды (Gotaas and Galler, 1973). Однако мнения о том, какое из них является наилучшим, расходятся. Поскольку основным назначением биологического (или нитрифицирующего) фильтра является превращение аммиака в нитрат, важное значение имеет концентрация аммиака в поступающей на фильтрацию воде. Городские стоки характеризуются концентрациями аммиака 10 мг NH3—N/л и выше. Для рыбоводных целей допустимы значительно более низкие концентрации аммиака — 1 мг NH3—N/л или менее для лосося и форели, хотя другие виды (например, сомик) могут переносить и более высокие концентрации. В литературе не содержится сведений о том, зависит ли скорость нитрификации от концентрации NH3—N в поступающей на фильтр воде. Есть основания полагать, что эта зависимость проявляется при низких концентрациях, но не заметна при более высоких.
Первая методика расчёта
Методика расчёта, разработанная Лиао и Майо, в обобщенном виде изложена в их работе 1974 г., а более подробно в работе 1972 г. На основании работ с форелью эти исследователи вывели следующую систему:
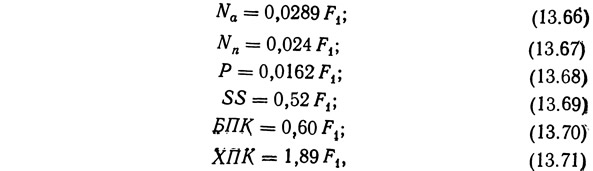
где Nа — скорость выделения аммиака при температуре 10—15°С, кг NH4—N на 100 кг рыбы в сутки; Nn — скорость образования нитрата при температуре 10—15°С, кг NO3—N на 100 кг рыбы в сутки; Р — скорость образования фосфата при температуре 10—15°С, кг РO4—Р на 100 кг рыбы в сутки; SS — скорость образования взвешенного твердого вещества при температуре 10—15°С, кг взвешенного вещества на 100 кг рыбы в сутки; БПК — биохимическое потребление кислорода при температуре 10—15°С, кг БПК на 100 кг рыбы, в сутки; ХПК— химическое потребление кислорода при температуре 10—15°С, кг ХПК на 100 кг рыбы в сутки; Fs — интенсивность кормления, кг корма на 100 кг рыбы в сутки.
Хотя согласно соотношениям (13.66) — (13.71) при нулевой интенсивности кормления продукты обмена не образуются, это не так, поскольку продукты обмена являются результатом катаболизма тканей тела. Следовательно, эти уравнения неприменимы при низкой интенсивности кормления, когда рыбы начинают фактически голодать. Во всяком случае в промышленном рыбоводстве такой низкой интенсивности кормления быть не должно.
Уравнения (13.66) — (13.71) дают оценку скорости образования продуктов обмена для форели в системах с рециркуляцией до 90% воды. Они были выведены в результате работ по выращиванию форели при температуре 10—15°С и плотности посадки до 28,4 кг на 1 м3 воды в бассейне, не считая воду в других частях системы. Лиао и Майо (Liao and Mayo, 1970) не претендуют на достоверность этих уравнений для других условий.
Вторым важным параметром, который необходим при расчете фильтра, является интенсивность потребления кислорода рыбой. Лиао (Liao, 1971) предлагает следующие уравнения для вычисления интенсивности потребления кислорода лососевыми:
где Ос — интенсивность потребления кислорода, фунты O2 на 100 фунтов рыбы в сутки; К2 — постоянная скорости; Т — температура, °F; а, b — наклоны кривых; W — вес рыбы, фунт.
Постоянные K2, а и b приведены в табл. 13.5. Следует отметить, что они действительны только для лосося и форели. Величины, входящие в уравнение (13.72), выражены в фунтах, так как имеющихся данных недостаточно для пересчета постоянных в единицы международной системы СИ.

Концентрацию растворенного кислорода в воде, поступающей в систему аквакультуры, можно рассчитать по следующему уравнению (Liao et al., 1972):
где Ci — концентрация кислорода при температуре воды Т (в °F) и высоте над уровнем моря E1 (в футах), мг/л; S — коэффициент насыщения, обычно он не превышает 0,95.
Пропускная способность системы (Liao et al, 1972)
где Le — пропускная способность, кг рыбы/(л·мин); Се — концентрация растворенного кислорода при температуре Т и высоте над уровнем моря Е1, мг/л; Cm — минимальная допустимая концентрация кислорода в пруду, мг/л; Ос — интенсивность потребления кислорода, кг O2 на 100 кг рыбы.
Пайпер (Piper, 1970) вывел выражение для расчета пропускной способности системы, основанное на длине и весе рыбы,
где L0 — плотность посадки; L — длина рыбы, см; I — расход, л/мин; W — заданный допустимый вес рыбы, кг.
При расчете плотности посадки Пайпер исходил из следующих предположений: пропускная способность системы ограничена потреблением кислорода и накоплением продуктов обмена; количество потребляемого кислорода и количество продуктов обмена пропорциональны количеству потребляемого корма. Следовательно, определив плотность посадки для рыб любой длины, можно с помощью уравнения (13.75) рассчитать вес рыбы данной длины, который может выдержать система, перестроив уравнение так, чтобы W оказался в левой его части. Уравнение (13.75), по-видимому, применимо к лососю и форели.
Следует также отметить, что ни уравнение (13.74), ни уравнение (13.75) не учитывает влияния накопления продуктов обмена веществ в замкнутой системе.
Лиао и Майо (Liao and Mayo, 1972) вывели уравнение для определения концентрации продуктов обмена в воде, выходящей из системы с частичной циркуляцией воды, оборудованной биофильтром:
где R — количество циркулируемой воды, %; Е — количество продуктов обмена, задерживаемых при одном проходе через фильтр, %; С — концентрация продуктов обмена в воде, выходящей из системы, отнесенная к их концентрации в воде, прошедшей через фильтр.
Таким образом, С=1,0 при одном проходе через фильтр. Результаты решения уравнения для С при различных значениях R для системы без фильтра (т. е. E=0) приведены в табл. 13.6.
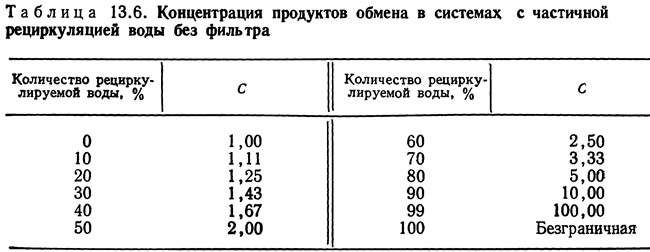
Из таблицы видно, что стабилизированная концентрация продуктов обмена в системе с рециркуляцией без фильтрации рециркулируемой воды логарифмически возрастает с увеличением количества рециркулируемой воды. С увеличением эффективности фильтрации (т. е. количества продуктов обмена, удаляемых при рециркуляции) стабилизированная концентрация снижается. Например, при 100%-ной рециркуляции и 50%-ной эффективности фильтра С=2,0. Следовательно, для поддержания заданной концентрации продукта обмена (например, аммиака) эффективность фильтрации должна возрастать с увеличением количества рециркулируемой воды.
Лиао и др. (1972) вывели также зависимость количества образующегося аммиака Na от потребления кислорода Ос [уравнение (13.77) или (13.78)]:
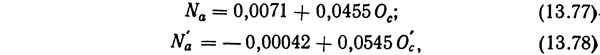
где N'a — количество аммиака, выделяющееся при температуре 10—15°С, кг NH+4—N на 1 кг корма в сутки; Ос — количество потребляемого кислорода при температуре 10—15°С, кг O2 на 1 кг корма в сутки.
Уравнения (13.77) и (13.78) выведены при следующих условиях: длина форели 7,6—27,9 см; температура воды 10—15°С; скорость воды 15—30 см/с; интенсивность кормления вычислялась по> формуле Батербау и Уиллоуби (Buterbaugh and Willoughby, 1967).
Лиао и др. (1972) обнаружили, что окисление аммиака в фильтре зависит от содержания органических и питательных веществ, гидравлической нагрузки, температуры, pH, концентрации кислорода и времени удерживания. Следовательно, для расчетных целей необходимо установить зависимость между этими переменными.
Ниже приведены зависимости между окислением аммиака и его концентрацией для капельного фильтра и двух восходящих биологических фильтров при разном времени удерживания (Liaa et al., 1972).

где NAR — скорость окисления аммиака в фильтре при указанном времени удерживания, кг NH+4—N/(м2·сут) 10-5; AL — концентрация аммиака, кг NH+4—N/(м2·сут) 10-5.

Уравнения (13.79) — (13.83) выведены при следующих условиях: температурный диапазон 10—15°С; гидравлическая нагрузка 1,0—1,7 л/с на 1 м2 горизонтальной поверхности фильтра; pH 7,5—8,0; наполнитель фильтра — пластмассовые кольца Коха2 размером 8,75 см.
Кроме того, максимальная концентрация аммиака в воде не должна превышать 97,б·10-5 кг NH4—N/(м2·сут). Лиао и др. (1972) установили, что при более высоких концентрациях органические вещества, содержащиеся в воде, снижают нитрификацион-ную способность фильтра.
Было показано, что гидравлическая нагрузка в пределах от 1,0 до 1,7 л/с на 1 м2 поверхности фильтра не влияет на скорость окисления аммиака в фильтре (Liao et al., 1972). Следовательно, основным параметром, влияющим на интенсивность удаления аммиака, является время удерживания. Этого и следовало ожидать, так как нитрифицирующие бактерии характеризуются более продолжительным временем генерации по сравнению с большинством гетеротрофных бактерий (Meade, 1974).
Зависимость между интенсивностью окисления аммиака и временем удерживания при разной концентрации аммиака имеет следующий вид (Liao et al., 1972):
где NAR — скорость окисления аммиака в фильтре при температуре 10—15°С, кг NH4—N/(м2·сут); AL — концентрация аммиака, кг NH4—N/(м2·сут); tm — время удерживания, ч.
Перестроив уравнение (13.86), получим
где ЕA — эффективность окисления аммиака при температуре 10—15°С.
Уравнение (13.87) выведено при следующих условиях: время удерживания 0,206—0,46 ч; гидравлическая нагрузка менее 101 л/(мин·м2); температура воды 10—15 °С; концентрация аммиака около 1 мг NH4—N/л и менее; интенсивность поступления аммиака менее 97,6 кг NH4—N/(м2·сут).
Весьма желательно было бы расширить диапазон температур уравнения (13.87). Для этого необходимо установить зависимость между константой скорости нитрификации К и температурой. Это выражение можно было бы подставить в уравнение (13.87) вместо существующей константы скорости (т. е. 0,96).
Зависимость между скоростью нитрификации и температурой выведена несколькими исследователями. Лиао и др. (1972) ссылаясь на работу Даунинга (Downing, 1968) предложили для описания этой зависимости уравнение (13.88), а Даунинг и Ноулес (Downing and Knowles, 1967) — уравнение (13.89).
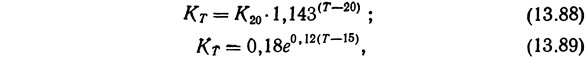
где КT — постоянная Скорости нитрификации при температуре Т; К20 — постоянная скорости нитрификации при температуре 20°С; Т — температура, °С.
Хог и Маккарти (1971), проводившие эксперименты с погружным фильтром и синтетическими стоками, не содержавшими органических веществ, вывели следующее уравнение, связывающее скорость нитрификации К и температуру (в °С):
Уравнения (13.88) и (13.90) постулируют соответственно логарифмическое и линейное изменение константы нитрификации Кт в-зависимости от температуры. Уравнение (13.90) было выведена при работе с синтетическими стоками, не содержавшими органических примесей, тогда как уравнение (13.89) относится к стокам, содержавшим как органические вещества, так и аммиак. В обеих системах содержание аммиака значительно превышало допустимое при выращивании лососевых. Так, в исследованиях Хога и Маккарти (1971) концентрация аммиака на входе в фильтр составляла в среднем около 10 мг NH3—N/л. Поскольку Лиао и др. (1972) показали, что на работу нитрификационного фильтра большое влияние оказывает концентрация аммиака в поступающей воде, приведенные выше уравнения не могут быть непосредственно применены к фильтрам систем для разведения лососевых.
Лиао и др. (1972) использовали свои данные и температуру (1,67°С), при которой согласно уравнению (13.90) постоянная КT=0, для выведения уравнения (13.91). Таким образом, эта уравнение выведено, по существу, на основании двух заданных точек (1,67°С и 12°С) с использованием результатов двух разных исследований, а также обнаруженной Хогом и Маккарти (1971) линейной зависимости между постоянной нитрификации Кт и температурой [см. уравнение (13.90)], что позволяет провести прямую линию между двумя заданными точками.
Несмотря на принятые при выведении уравнения (13.91) допущения, оно, по-видимому, дает более правильную оценку константы — скорости нитрификации, чем уравнения (13.88) и (13.90), так как оно, по крайней мере частично, опирается на данные, полученные при рыбоводных работах и концентрации аммиака, имеющие практическое значение для рыбоводных систем. Однако при расчете постоянной скорости нитрификации для систем, в которых содержатся не лососевые, а другие рыбы, например, сомик-кошка, уравнение (13.90) может оказаться более пригодным. Кроме того, уравнение (13.90) было выведено на основе данных, полученных при температурах от 5 до 25°С, а уравнение (13.91) — 1,67 и 12°С.
Выбранную зависимость (13.90) или (13.91) можно подставить в уравнение (13.87) для получения оценки эффективности окисления аммиака нитрифицирующими бактериями фильтра при разных значениях температуры и времени удерживания. Поскольку уравнение (13.87) было получено при работе с системами для выращивания лососевых, уравнение (13.91) использовано здесь для выведения уравнения (13.92). Прямая подстановка уравнения {13.87) в уравнение (13.91) дает коэффициенты, несколько отличающиеся от коэффициентов в уравнении (13.92). Уравнение {13.92) взято непосредственно из работы Лиао и др. (1972), и, по-видимому, разница в коэффициентах является результатом округления или различий в самих исходных данных, вводимых в уравнения.
где ЕT — нитрификационная способность фильтра, %; tm — время удерживания, ч; Т — температура воды, °С.
Приведенные выше уравнения применимы, по-видимому, к расчету нитрифицирующих фильтров для лососевых, хотя выведены они были на основании работ главным образом с форелью. Эта методика расчета основана на данных, полученных многими исследователями, но расчетные уравнения выведены в основном Лиао и Майо. Примерно в это же время Спис (Speece, 1973) разработал методику расчета нитрифицирующих фильтров для лососевых, особенно форели. Методика Списа опирается на графическое представление данных, что позволяет брать соответствующие значения с графиков.
Вторая методика расчета
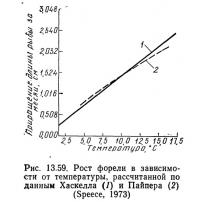
На основании работ Хаскелла (Haskell, 1955, 1959), Пайпера (Piper, 1970) и Батербау и Уиллоуби (1967) Спис (1973) построил график, приведенный на рис. 13.59. Количество корма, необходимое для форели заводского выращивания, определяется по следующей формуле (Haskell, 1959):

где суточный прирост длины и длина рыбы должны быть выражены в одних и тех же единицах.
Батербау и Уиллоуби (1967) отмечают, что для конкретного вида рыбы при постоянной температуре воды и одинаковом корме числитель уравнения (13.93) является постоянной величиной. Они назвали эту постоянную «заводской константой» и переписали уравнение (13.93) следующим образом:
Хаскелл (1959) разработал теорию «температурной единицы», согласно которой для одного вида рыбы мажно предсказать темп роста при любой температуре в диапазоне от 3,6 до 15,5°С. Число температурных единиц — это среднемесячная температура воды минус 3,67°С. Хаскелл вывел зависимость, которая показывает, что рост форели линейно связан с температурными единицами в диапазоне от 3,6 до 15,5 °С. В соответствии с этой зависимостью рост равен нулю при 3,6 °С. Батербау и Уиллоуби (1967) расширили эту концепцию, связав заводскую константу с температурой воды. Спис (1973) указывает, что Боуэн пересмотрел систему «температурных единиц» Хаскелла и в качестве единицы отсчета принял 0°С вместо 3,6°С. Приняв этот новый уровень отсчета и темп роста, равный 1,52 см в месяц при 10°С, Спис (1973) нанес результаты Хаскелла на график (см. рис. 13.59). Если темп роста лососевых при температуре 10°С известен, то можно определить темп их роста при любой температуре от 4,4 до 15,5°С (Speece, 1973). При температуре выше 10°С темп роста будет увеличиваться на 7,2%, а при температуре ниже 10°С — снижаться на 9% на каждый градус. Данные Берроу (Burrough, 1968) по сеголеткам чавычи соответствуют модели Пайпера (см. рис. 13.59) в диапазоне 7,2—15,5°С.
Спис (1973) вывел зависимость между выделением аммиака на фунт корма и температурой (рис. 13.60). Эта зависимость была получена на основе данных Рыбоводного центра Бозмена (США) (Bozeman Fish Cultural Development Center, 1970), где было выведено следующее уравнение для определения аммиачного коэффициента:
где NA — концентрация аммиака, мг NH3—N/л; Q — проточность, л/с; F — норма кормления, кг.
Используя аммиачный коэффициент, данные, имеющиеся по температурам 9,4 и 16,7°С, и уравнение (13.95), Спис (1973) построил график, показанный на рис. 13.60. Он вычислил, что при Температуре 9,4°С выделяется 0,026 кг NH3—N, а при температуре 16,7°С — 0,032 NH3—N на 1 кг корма. Взяв эти две точки и предположив линейную зависимость, Спис (1973) построил график, показанный на рис. 13.60. По данным Рыбоводного центра Бозмена (1970), количество аммиака, выделяющегося на 1 кг корма, остается приблизительно постоянным при изменениях концентрации белка в корме в пределах 5%. Эти данные также показывают, что содержание аммиака в воде прямо пропорционально количеству заданного корма и проточности воды, но не объему или частоте смены воды в выростном канале.
Спис (1973) также установил зависимость между скоростью нитрификации в фильтре и температурой. Хог и Маккарти (1970) вывели уравнение, связывающее скорость нитрификации в погружном фильтре и температуру. В их экспериментах концентрация аммиака в поступающей в фильтр воде составляла приблизительно 10 мг/л, т. е. значительно превышала допустимую в системах для разведения лососевых:
где dCA/dt — изменение концентрации аммиака СА со временем в погружном фильтре, мг/л; Т — температура, °С.
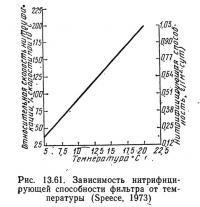
Работая с гравийным фильтром (диаметр гравия 1,9 см), Гиггер и Спис (Gigger and Spece, 1970) обнаружили, что при концентрации аммиака на вхдце около 0,5 мг NH3—N/л скорость нитрификации при 20 °С составляла 0,001 кг NH3—N/(м2·сут). Взяв это значение и уравнение (13.90), Спис построил график зависимости нитрифицирующей способности единицы площади поверхности фильтра от температуры (рис. 13.61). Если для построения этого графика взять уравнение (13.91), наклон будет несколько больше, хотя разница пренебрежимо мала.
Остальные расчетные графики Списа основаны на предположениях, принятых при построении графика, показанного на рис. 13.59: темп роста рыбы равен 1,5 см в месяц при температуре 10 °С, кормовой коэффициент равен 1,5. Если эти значения не подходят для какого-либо конкретного случая, их можно изменить при условии внесения соответствующих изменений во все графики.
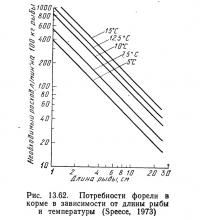
Спис (1973) построил график, показанный на рис. 13.62, вычислив заводские константы для каждой температуры и нанося их на вертикальную и горизонтальную оси графика с помощью методики Пайпера (в изложении Списа). Соединив прямой линией соответствующие точки на этом графике, построенном в логарифмическом масштабе, он получил норму кормления для рыбы любой длины при любой температуре в диапазоне 5—15°С.
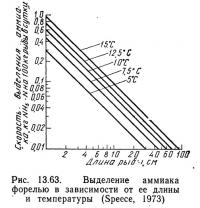
График, .показанный на рис. 13.63, был построен с использованием данных графиков, приведенных на рис. 13.60 и 13.62. Значения для этого графика были рассчитаны по уравнению (13.97).
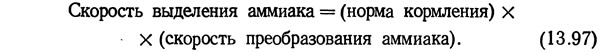
Интенсивность кормления для рыбы заданной длины при определенной температуре была взята с графика на рис. 13.62, а скорость окисления аммиака при соответствующей температуре — с графика на рис. 13.60. Пересчет длины на вес выполнен по графикам Батербау и Уиллоуби (1967).
Затем были рассмотрены требования к качеству воды. Методика Списа требует знания желаемой или допустимой максимальной концентрации аммиака в воде, выходящей из фильтра. Для приведенных здесь графиков эта величина была принята равной 0,5 мг/л. Используя эту величину, можно рассчитать необходимую проточность:
где Q/W — проточность на единицу массы рыбы; WA/W — количество аммиака, выделяемого на единицу массы рыбы; Eq — желаемая концентрация аммиака в воде.
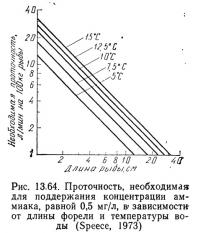
Например, проточность (в л/с), необходимую для содержания 100 кг форели длиной 10 см при 10°С, можно вычислить следующим образом. Возьмем количество выделяемого аммиака с графика на рис. 13.63 и подставим его в уравнение (13.98):
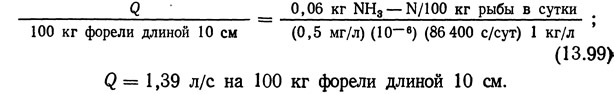
Проточность, необходимая для содержания 100 кг рыбы при концентрации аммиака 0,5 мг/л, в зависимости от длины рыбы и температуры показана на рис. 13.64. Можно построить также график зависимости плотности посадки рыбы от ее длины. На графике с логарифмической сеткой такая зависимость представляла бы собой семейство прямых линий с отрицательными наклонами, причем прямая для 15°С располагалась бы вверху, а для 5°С — внизу.
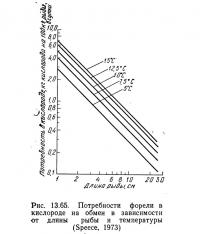
Для обеспечения высокого качества продукции помимо токсичности аммиака необходимо также учитывать потребности в кислороде. Уиллоуби (Willoughby, 1968) показал, что для усвоения форелью 1 кг гранулированного корма требуется 0,22 кг кислорода. Кроме того, это отношение должно оставаться постоянным в температурном диапазоне от 4,4 до 15,5°С. Спис (1973) использовал эти данные для выведения зависимости между потребностями в кислороде (в кг Ог) и количеством задаваемого корма:
На рис. 13.65 показана потребность в кислороде для рыб разной длины при нескольких значениях температуры.
Определив потребности в кислороде и проточность, можно рассчитать снижение содержания кислорода в результате протекания процессов обмена:
где ΔDO — изменение концентрации растворенного кислорода, мг/л; Qc — потребление кислорода, кг на 100 кг рыбы в сутки; Q — проточность, л/с на 100 кг рыбы.
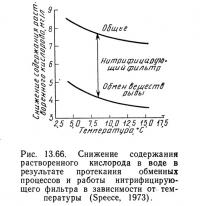
На рис. 13.66 уравнение (13.101) представлено в виде графика для проточности 1,18 л/с на 100 кг рыбы и потребления кислорода 0,4 кг O2 на 100 кг рыбы в сутки. Нижняя кривая — это потребляемый рыбой кислород, вычисленный по уравнению (13.101). Снижение содержания кислорода при любой температуре постоянно независимо от длины рыбы. Кроме того, снижение содержания кислорода ускоряется при более низких температурах, так как при этом на единицу корма выделяется меньше аммиака. Это снижает требуемый расход воды для удаления аммиака, но потребность в кислороде почти не изменяется.
Уравнение (13.101) позволяет вычислить потребление кислорода рыбой, но не учитывает утилизации кислорода бактериями фильтра. Гиггер и Спис (1970) утверждают, что кислородные потребности фильтра составляют примерно 150% стехиометрических потребностей кислорода на нитрификацию. Поскольку для окисления 1 мг NH3—N/л стехиометрически необходимо 4,5 мг/л кислорода, то кислородные потребности нитрифицирующего фильтра составят:
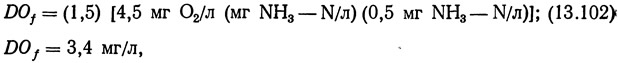
где DOf — потребности нитрифицирующего фильтра в растворенном кислороде; 0,5 мг NH3—N/л — максимально допустимая концентрация NH3—N в системе.
Таким образом, общая потребность в кислороде складывается из потребностей фильтра и потребностей рыбы (см. рис. 13.66). Необходимо отметить, что Спис (1973) принял кислородную потребность фильтра в диапазоне температур 5—15°С постоянной,» поскольку концентрация аммиака в поступающей на фильтр воде поддерживается неизменной путем регулирования плотности посадки в зависимости от температуры. Правомерность этого допущения требует подтверждения.
Суточное выделение аммиака в зависимости от длины рыбы и температуры можно получить с графика рис. 13.63, а скорость окисления аммиака погружным нитрифицирующим фильтром — с графика рис. 13.61. По этим данным с помощью уравнения (13.103) можно вычислить удельную площадь поверхности фильтра, необходимую для обеспечения требуемой скорости нитрификации. Удельная площадь поверхности фильтра — это площадь субстрата (гравий или пластмассовые кольца), доступная для развития бактерий.
где SSA — удельная площадь поверхности фильтра, м2 на 100 кг рыбы.
На рис. 13.67 показан график зависимости удельной площади поверхности фильтра от длины рыбы и температуры. Спис (1973) указывает, что в диапазоне температур от 5 до 15°С необходимая удельная площадь поверхности не зависит от температуры. Он объясняет это тем, что как выделение аммиака, так и интенсивность кормления меняются в зависимости от температуры, и изменения скорости нитрификации совпадают с этими изменениями.
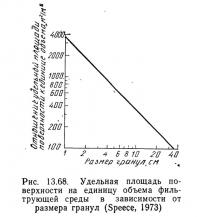
Спис (1973) вывел также зависимость между удельной площадью поверхности на единицу объема загрузки фильтра (гравий) и размером частиц гравия (рис. 13.68). Для одного типа загрузки эта зависимость может быть правильной, а для другого — нет, например для пластмассовых колец она не годится, поэтому такой график необходимо строить для каждого конкретного случая.
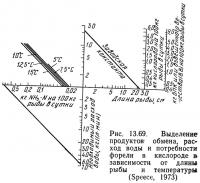
Спис (1973) объединил приведенные выше графики в два расчетных графика (рис. 13.69 и 13.70). На рис. 13.69 показан один такой график для расчета количества продуктов обмена, т. е. нагрузки на фильтры и необходимой проточности. Заводскую константу определяют для конкретного рыбоводного завода и откладывают по вертикальной и горизонтальной осям графика, затем обе точки соединяют прямой линией.
Методика расчета с помощью графика, показанного на рис. 13.69, заключается в следующем. На горизонтальной оси выбирают длину рыбы и из этой точки восстанавливают перпендикуляр до пересечения с линией заводской константы. От точки пересечения проводят горизонтальную линию влево и вправо. Справа подучают значение БПК или количество образующихся взвешенных веществ. Слева считывают интенсивность кормления и продолжают горизонтальную линию до пересечения с линией необходимой температуры. От точки пересечения с этой линией проводят линию вертикально вниз и получают количество выделяемого аммиака. Вертикальную линию продолжают вниз до пересечения с наклонной линией. От точки пересечения проводят горизонтальную линию вправо и получают необходимую проточность.
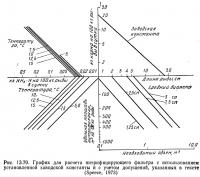
С помощью графика на рис. 13.70 можно рассчитать необходимую удельную площадь поверхности нитрифицирующего фильтра (с учетом 10 условий, перечисленных ниже). Из точки, соответствующей длине рыбы, восстанавливают перпендикуляр до пересечения с линией заводской константы. От точки пересечения проводят горизонтальную линию до пересечения с линией температуры. От этой точки проводят вертикальную линию до тех пор, пока она снова не пересечет линию температуры. Затем проводят горизонтальную линию и получают значение необходимой удельной площади поверхности. Горизонтальную линию продолжают до пересечения с линией среднего диаметра частиц гравия. Вертикальная проекция этой точки вниз дает значение необходимой загрузки фильтра.
Графики, показанные на рис. 13.69 и 13.70, применимы только к системам, отвечающим условиям, указанным выше при обсуждении графиков. К основным условиям относятся следующие: температура 4,4—15,6°С; темп роста 1,52 см в месяц при температуре 10°С; количество кислорода, необходимое для утилизации 1 кг корма, равно 0,22 кг; количество выделяющегося аммиака связано линейной зависимостью с температурой; уравнение Хога и Маккарти (1971), связывающее константу нитрификации с температурой, справедливо для фильтров рыбоводных систем; кормовой коэффициент равен 1,5:1, предельно допустимая концентрация аммиака на выходе системы составляет 0,5 кг NH3—N/л; система предназначена для выращивания форели, хотя графики можно применять и для других лососевых; удельная площадь поверхности среды фильтра связана указанной выше зависимостью с объемом и диаметром частиц; заводская константа соответствует указанной на графике.
Нарушение этих исходных условий делает графики, приведенные на рис. 13.69 и 13.70, полностью или частично непригодными. Некоторые отклонения можно скорректировать путем внесения поправок в соответствии с конкретными условиями, другие (например, вид рыбы) делают весь график ненадежным или недействительным.
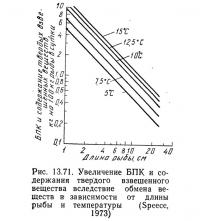
До сих пор БПК и содержание взвешенных веществ (ВВ) в; расчетах не учитывалось, хотя и Спис (1973), и Лиао и др. (1972) принимали эти два параметра во внимание. Спис (1973) обнаружил, что на 1 кг сухих фекалий рыбы, находящихся во взвешенном состоянии, расходуется примерно 1 кг кислорода. Эксперименты (Speece, 3973) показали, что при скармливании 1 кг форелевого корма сомику-кошке и полной его утилизации вырабатывалось 0,4 кг сухих фекалий. Таким обраозм, на 1 кг корма БПК оказалось равным 0,4 кг. Спис считает, что это достаточно хорошо согласуется с данными Лиао (Liao, 1970).
Используя это соотношение (т. е. количество фекалий — количество утилизированного корма) и исходя из предположения, что оно не зависит от длины рыбы и температуры, Спис (1973) построил график зависимости БПК и содержания ВВ от длины рыбы и температуры (рис. 13.71; см. также рис. 13.69). Выявлена также зависимость БПК и ВВ от интенсивности кормления, которая обсуждалась выше.
Лиао и др. (1972) вывели уравнения зависимости между содержанием ВВ, БПК, ХПК и интенсивностью кормления [уравнения (13.69), (13.70) и (13.71) соответственно]. В соответствии с их данными увеличение содержания органических веществ в воде снижает скорость нитрификации в фильтрах. К такому же выводу пришли Гиггер и Спис (1970), Мид (1974) и Дадлз и Ричардсон (Duddles and Richardson, 1973). Ломакс (Lomax, 1976) провел опыты по изучению влияния содержания органических веществ на скорость нитрификации в фильтрах замкнутых систем для выращивания сомика. Ему не удалось выявить статистически достоверной зависимости при общем содержании взвешенных веществ в диапазоне от 436 до 898 мг/л.
Последовательность расчета
Методика Списа заключается главным образом в правильном построении графиков и считывании с них соответствующих данных. Эта методика достаточно подробно обсуждалась выше и не требует дополнительных разъяснений.
Методика Лиао и Майо несколько сложнее, и ниже приводится последовательность расчета по этой методике.
1. Вычисляют необходимую проточность:
а) определяют пропускную способность либо по уравнениям {13.72) — (13.74), либо с помощью методики Пайпера [уравнение (13.75)];
б) определяют общий расход воды Q делением общего количества рыбы W на пропускную способность Le.
2. Определяют общую концентрацию аммиака WA.
Метод 1-й:
а) определяют скорость выделения аммиака NA по уравнению. (13.77);
б) умножают общее количество рыбы W на скорость выделения аммиака NA для определения общего количества выделяющегося аммиака WA.
Метод 2-й:
а) определяют интенсивность кормления и вычисляют количество выделяющегося аммиака NA по уравнению (13.66);
б) то же, что в пункте (б) метода 1-го.
3. Вычисляют показатель концентрации аммиака С:
а) определяют исходную концентрацию аммиака Сi по уравнению
где К4 — константа, зависящая от размерности величин (например, К4=702,4, если WA выражено в кг/сут, Q в л/мин и Ci в мг/л);
б) выбирают допустимую концентрацию аммиака C2 из табл. 13.7;
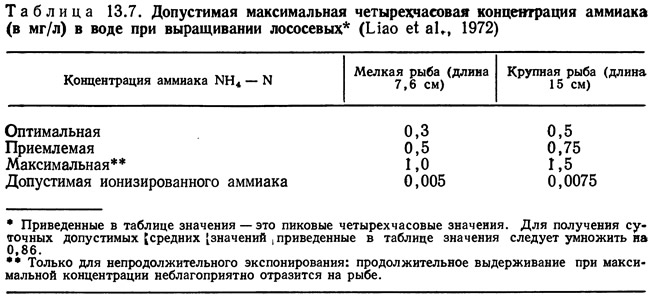
в) вычисляют показатель концентрации аммиака:
4. Вычисляют требуемую эффективность окисления аммиака фильтром:
а) определяют необходимое количество (в %) рециркулируемой воды R путем сопоставления необходимого общего расхода (см. пункт 1) с имеющимся количеством воды или назначают количество рециркулируемой воды.
б) вычисляют эффективность фильтра3 путем перегруппировки уравнения (13.76) следующим образом:
5. Вычисляют общую аммиачную нагрузку на фильтр WAF.
При рециркуляции воды суммарная аммиачная нагрузка на фильтр увеличивается по сравнению с первоначальной концентрацией (т. е. с концентрацией аммиака на выходе аналогичной системы с одноразовым использованием воды).
6. Вычисляют необходимую загрузку фильтра:
а) определяют необходимое время удерживания загрузкой фильтра с помощью уравнения (13.92), перегруппированного следующим образом:
б) выбирают материал загрузки фильтра и определяют удельную площадь поверхности на единицу объема А и размер пор е. Ломакс (1976) разработал метод определения удельной площади поверхности гравия;
в) корректируют время удерживания-фильтром с учетом снижения времени удерживания твердыми частицами загрузки по следующему уравнению:
г) вычисляют необходимый объем загрузки фильтра.
где Q — общий расход воды;
д) определяют общую удельную площадь поверхности среды.
е) проверяют не превышает ли интенсивность аммиачной нагрузки 9,77·10-5 кг NH4—N/(м2·сут).
7. Вычисляют параметры фильтра:
а)выбирают или определяют желательную гидравлическую нагрузку HL;
б) вычисляют площадь поперечного сечения фильтра.
в) определяют объем фильтра Vf с помощью уравнений (13.110) и (13.111).
где tf — время удерживания фильтром; tm1 — время удерживания загрузкой фильтра.
Постоянная 1,6 в уравнении (13.110) получена как отношение объема фильтровального бассейна, использованного в экспериментах Рыбоводного центра Бозмена к объему фильтрующей нагрузки. Эта величина зависит от фильтра.
г) вычисляют глубину фильтра Df и глубину загрузки фильтрующего слоя Dm.
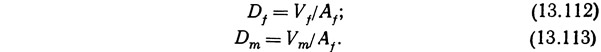
Глубина фильтрующего слоя должна быть не менее 1 м для предотвращения возникновения застойных зон и частичной закупорки фильтра органическими веществами и отмершими бактериями. Частичная закупорка фильтра увеличивает также возможность образования в фильтре анаэробных участков и, следовательно, метана и сероводорода. Берроуз и Комбз (1968) и Лиао и др. (1972) рекомендуют минимальную глубину фильтра не менее 1,22 м.
Объем фильтрующего слоя также важен при расчете. Если используется гравий, то чем меньше диаметр частиц, тем больше удельная площадь поверхности на единицу объема. Следовательно, мелкий гравий обеспечивает необходимую удельную площадь поверхности при меньшем размере фильтра. Однако чем мельче гравий, тем быстрее взвешенные частицы и отмершие бактерии засоряют фильтр и тем чаще возникает необходимость обратной промывки фильтра. Засорение ведет к чрезмерной потере напора, уменьшению расхода и увеличению риска образования в фильтре анаэробных участков. С обратной промывкой удаляется большое количество нитрифицирующих бактерий и снижается производительность фильтра. Итак, мелкие частицы обеспечивают увеличение площади поверхности на единицу объема, но при этом возникает проблема засорения. Диаметр частиц гравия следует выбирать с учетом желательности устранения или сведения к минимуму необходимости обратной промывки. Наполнитель фильтра из пластмассы диаметром 2,5—7,5 см, по-видимому, удовлетворяет требованиям в отношении засорения и в то же время обеспечивает достаточную площадь поверхности на единицу объема. Гравий должен быть размером не менее 2 см, а желательно и крупнее, чтобы предотвратить засорение. Спотт (Spotte, 1970) рекомендует использовать в качестве фильтрующей среды гравий диаметром 2—4 мм. Хотя такой диаметр частиц слишком мал для промышленных систем из-за высокого содержания в них органических веществ, он может быть подходящим для небольших аквариумов, где вода должна быть прозрачной.
Третья методика расчета
Спис (1973) и Лиао и др. (1972) разработали собственные методики расчета для пресноводных лососевых хозяйств и диапазона температур 15—16°С Расчету нитрифицирующих фильтров для систем до сих пор не уделялось внимания. Однако Хираяма (Hirayama, 1966) вывел уравнение для пропускной способности небольших морских систем:
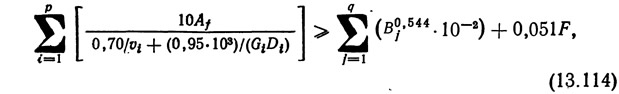
где Af — площадь поверхности фильтрующего слоя, м2; v — скорость фильтрования, см/мин; D — глубина фильтра, см; р — число фильтров, обслуживающих систему; G — коэффициент размера частиц гравия [см. уравнение (13.115)]; В — вес одной рыбы, г; F — количество задаваемого в сутки корма, г; q — число рыб в системе.
Коэффициент размера частиц гравия
где R — средний размер частиц каждой фракции гравия в фильтрующем слое, мм; X — вес каждой размерной фракции, %.
Левая часть уравнения (13.114) — это окислительная способность фильтра или фильтров системы, а правая — скорость образования продуктов обмена в системе. Следует отметить, что скорость фильтрования включает время удерживания, так как принимается, что объем пустот фильтра постоянен, тогда как коэффициент размера частиц учитывает изменение удельной площади поверхности фильтра на единицу объема с изменением размера частиц фильтрующей среды. Кроме того, система может вынести нагрузку с большим общим весом крупных рыб, чем мелких. Это согласуется с наблюдениями Списа (1973) и Лиао и Майо (1974), которые отмечают, что более крупные рыбы потребляют меньше корма на единицу веса и выделяют меньше продуктов обмена на единицу веса, чем мелкие.
Примечания
1. Концентрация, при которой гибнут 50% особей.
2. Фирменное название пластмассовых колец.
3. Лиао и др. (1972) обнаружили, что если необходимая эффективность фильтра не превышает 20%, достаточно эффективным оказывается отстойник с временем удерживания 1 ч.